基元反應
基元反應
基元反應是指在反應中一步直接轉化為產物的反應,又稱為簡單反應。化學反應式多數情況下不能說明反應的過程。現實中有的反應是一步完成,而多數的反應需要經歷若干個步驟才能完成。
從微觀上看,反應物分子一般總是經過若干的簡單反應步驟,才最後轉化為產物分子的。每一個簡單的反應步驟,就是一個基元反應。基元反應步驟要求反應物一步變成生成物,沒有任何中間產物。按照基元反應定義,所有的可逆反應均為非基元反應。
基元反應方程式中各反應物分子數之和稱為反應分子數,按照反應分子個數可將基元反應劃分為單分子反應、雙分子反應和三分子反應,具體如下:
(1)單分子反應
方程式:A→產物
(2)雙分子反應
方程式:A+B→產物或者2A→產物
(3)三分子反應
方程式:A+B+C→產物或者2A+B→產物或者A+2B→產物
基元反應的動力學規律符合質量作用定律,即:基元反應的化學反應速率與反應物的濃度數值相應方次乘積成正比;其方次即為各物質前面係數,均取正值。具體如下:
(1)對於單分子反應:A→產物
對應的反應速率方程式為:v=k{c}
(2)對於雙分子反應A+B→產物或2A→產物
對應的反應速率方程式分別為:v=k{c}{c}或者v=k{c}
(3)對於三分子反應
A+B+C→產物
或者2A+B→產物
或者A+2B→產物
對應的反應速率方程式分別為:v=k{c}{c}{c}、v=k{c}{c}或者v=k{c}{c}
上述k值為速率常數,與溫度和催化劑有關,和反應物濃度無關。
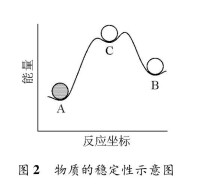
基元反應
同理,從微觀角度考察物理變化時,同一種物質之所以出現多種不同物理狀態,也是因為這些狀態彼此之間存在一定的能量障礙。這種能量障礙總是大於或等於0,但不可能小於0。如在自由氣體分子與被固體表面吸附的氣體分子之間,在基態分子與吸光后的激發態分子之間,在普通分子與發生碰撞後轉化的富能分子之間,都有一定的能量障礙。
從硬球碰撞理論的推導過程可以看出,對於從初態到終態有一定能量障礙的態變化過程,只有當相撞分子對具有足夠的能越過能量障礙的能量時態變化過程才有可能發生。這其中並未把有能量障礙的態變化過程只局限於化學變化。這就是說,硬球碰撞理論的結果---質量作用定律不僅適用於化學變化,也適用於物理變化;而且不論是化學變化還是物理變化,始終態之間只能有一個能峰。否則,硬球碰撞理論的思想方法和推導過程就不適用了,質量作用定律也就不適用了。所以,作為質量作用定律的適用對象,基元過程只能是兩個相鄰的有一個穩定性的狀態之間的變化,只能是基元反應或簡單的物理變化。此處“相鄰”一詞的含義是基元過程始終態之間的能量障礙表現為只有一個能峰,而不是多個能峰。此處的能峰高低對基元反應而言就是活化能大小。能峰可高可低,最低時可以為0。如兩個自由原子或自由基結合時活化能為0,即能峰高度為0。與基元過程對應的有一定穩定性的始終態的區別可以表現為化學組成或結構上的差異,也可以是相同分子的不同物理狀態的差異。在上圖中,A與C之間的變化是一個基元過程,C與B之間的變化也是一個基元過程,但A與B之間的變化不是一個基元過程,因為其中有兩個能峰。