氣體溶解度
氣體溶解度
氣體溶解度是指該氣體在壓強為101kPa,一定溫度下,溶解在1體積水裡達到飽和狀態時的氣體的體積。氣體溶解度受氣體種類、壓強、溫度等因素影響。如在0℃、1個標準大氣壓時1體積水能溶解0.049體積氧氣,此時氧氣的溶解度為0.049。氣體的溶解度除與氣體本性、溶劑性質有關外,還與溫度、壓強有關:其溶解度一般隨著溫度升高而減少。由於氣體溶解時體積變化很大,故其溶解度隨壓強增大而顯著增大。關於氣體溶解於液體的溶解度,在1803年英國化學家威廉·亨利,根據對稀溶液的研究總結出一條定律,稱為亨利定律。
溶,首決質,隨壓強溶劑溫化。例,℃,壓強.×^,升溶積:氨氣為702L,氫氣為0.01819L,氧氣為0.03102L。氨氣易溶於水,是因為氨氣是極性分子,水也是極性分子,而且氨氣分子跟水分子還能形成氫鍵,發生顯著的水合作用,所以,它的溶解度很大;而氫氣、氮氣是非極性分子,所以在水裡的溶解度很小。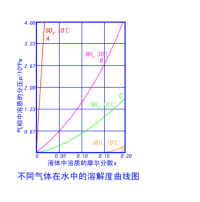

氣體溶解度
壓強,溶隨溫升減。例,溫升,分子運動速率加快,容易自水面逸出。
溫,溶隨壓強增增。壓強增,液濃增,,液液逸,溶。且,溶該壓強(壓)範圍(跟化化況)。例,℃,氫壓強.×^,氫升溶.;℃,×.×^,氫升溶.×=.。
氣體的溶解度有兩種表示方法,一種是在一定溫度下,氣體的壓強(或稱該氣體的分壓,不包括水蒸氣的壓強)是1.013×10^5Pa時,溶解於一體積水裡,達到飽和的氣體的體積(並需換算成在0℃時的體積數),即這種氣體在水裡的溶解度。另一種氣體的溶解度的表示方法是,在一定溫度下,該氣體在100g水裡,氣體的總壓強為1.013×10^5Pa(氣體的分壓加上當時水蒸氣的壓強)所溶解的克數。
以下為室溫、常壓下,氣體在水中的溶解度。
| 極易溶 | 易溶 | 可溶或能溶 | 微溶 | 難溶或不溶 | 與水反應 | |||
| 氣體 | NH | HX、HCNO、SO | CO2 | Cl | HS | CH | O、H、CO、NO、CH、CHCl、 CH、CH | F SO NO CO |
| 溶解度 | 700 | 40 | 1 | 2.26 | 2.6 | \ | \ | \ |
註釋:X表示F、Br、I等元素。HCl在常溫常壓下溶解度為1:500
