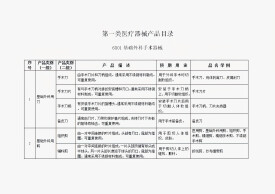
第一類醫療器械產品目錄
2014年05月30日國家食品藥品監督管理局發布
為做好第一類醫療器械備案管理,依據《醫療器械監督管理條例》(國務院令第650號)、《醫療器械分類規則》的有關規定,國家食品藥品監督管理總局組織制定了《第一類醫療器械產品目錄》。
目錄
通告
為做好第一類醫療器械備案管理,依據《醫療器械監督管理條例》(國務院令第650號)、《醫療器械分類規則》的有關規定,國家食品藥品監督管理總局組織制定了《第一類醫療器械產品目錄》,現予發布,並將有關事項通告如下:
一、本目錄是對2002版《醫療器械分類目錄》和相關分類界定文件中第一類醫療器械的歸納和整理,以目錄的形式細化和補充了有關內容。
二、本目錄在2002版《醫療器械分類目錄》的基礎上,擴展了產品類別,在相應產品類別下增加了“產品描述”和“預期用途”,並擴充了“品名舉例”中產品名稱。其中,“產品描述”和“預期用途”中的內容,是對每個產品類別下相關產品具有的共性內容的基本描述,用於指導具體產品所屬類別的判定;“品名舉例”所列舉的產品名稱為該類產品中常見的和具有代表性的名稱。
三、無菌形式提供的器械、含消毒劑的衛生材料、與內窺鏡配套使用的手術器械、使用過程中與椎間隙直接接觸的矯形外科(骨科)手術器械,均不屬於第一類醫療器械。
四、本目錄所列產品不包括組合包類產品和體外診斷試劑。
組合包類產品的分類按照醫療器械分類的有關規定執行,第一類體外診斷試劑按照《體外診斷試劑分類子目錄》的規定執行。
五、已發布的分類目錄及分類文件中的第一類產品與本目錄不同的,按本目錄執行。對於本目錄中未包含的產品,可按照2014年6月1日實施的《醫療器械監督管理條例》(國務院令第650號)第十六條的規定執行。
六、按照本目錄判定產品所屬類別,應根據產品的實際情況,通過目錄中“產品描述”、“預期用途”和“品名舉例”所描述或列舉的情形綜合判定。實施備案的醫療器械,其“產品描述”、“預期用途”的基本內容和產品名稱應符合本目錄中相關內容的範圍。