共找到2條詞條名為自由焓的結果 展開
- 自由焓
- 1876年吉布斯提出的概念
自由焓
自由焓
熱力學函數之一,是判斷等溫、等壓下冶金反應的方向及平衡態的依據。
目錄
有的書刊上稱它為:吉氏自由能(Gibbs free energy)。自由焓計算是冶金過程熱力學的中心內容和基本手段。
自由焓G 的定義是:
(1)
式中G為自由焓(焦),H為焓(焦),S為熵(焦/開),T為絕對溫度(開)。以上各參量一般均取 1摩爾的值。對純物質,自由焓與物質的化學本性及其狀態以及所處的溫度、壓力有關。對固體或距臨界溫度較遠的液體,壓力的影響可忽略不計。對溶液而言,自由焓還與溶液的組成有關。由A及B組成的二元溶液,其自由焓G:
(2)
式中,強Α、強B為組元A、B的偏摩爾自由焓,即化學勢,也即在恆溫恆壓下加入 1摩爾該組分到極大量的給定濃度溶液內所引起的自由焓變化。為組分A和B的摩爾數。
自由焓變數 一個等溫過程或反應的自由焓變數 ΔG根據式(1)為:
(3)
在等溫等壓下一個過程或反應能否自發地進行,取決於自由焓變數是負值還是正值。為負值的反應可以進行;負值越大,則該反應進行的趨勢越大。兩個同類型反應,其進行的先後順序取決於其負值的大小,負值大的反應優先進行。當,該反應達到平衡,也即反應向正方向進行的速度與向反方向進行的速度相等。對反應方程式
方括弧表示溶於金屬液中的A,也可用峎表示;而圓括弧表示溶於爐渣中的C,在中國也有用哫表示的。其平衡常數K為:
(4)
式中,分別代表平衡時組分A、C的活度和氣體組分D的分壓(大氣壓);B因是純固體物質,其活度為1,故從略。
反應的平衡常數K 與其標準自由焓變數的關係式為:
(5)
式中R為氣體常數,其值為8.314焦/(開·摩爾)。標準自由焓變數是反應物質和產物都處於標準狀態下的自由焓變數。對氣體來說,其標準態為1大氣壓下的純氣體。對溶液來說,其標準態可採用純物質或 1%濃度溶液。
對非標準態的反應,可用等溫方程式計算其:
(6)
J和K相似,但用實際的活度或壓力來表達。根據上列反應方程式,
順便指出,下面談到的ΔG或,均用自由焓或標準自由焓,而將“變數”二字省略。談到G 時用自由焓的絕對值即絕對自由焓。
化合物的標準生成自由焓 可用298K的標準生成焓ΔH圏、標準熵S圏和熱容Cp求出,其計算公式為:
(7)
自由焓
a、b為熱容Cp與溫度T關係式的常數;當只用兩項式時:
而
(8)
(9)
ΔS圏可用反應物及產物的標準熵S圏求出:
(10)
上列各式中,v為反應方程式中各物質的係數也即其摩爾數。下標p表示產物,r表示反應物。
化合物的標準生成自由焓也可用式(11)求出:
(11)
式中的和I是常數,可用已知的兩個溫度的該化合物的值求出。ΔH0也可用式(12)由已知某一溫度該化合物的求出:
(12)
溶解自由焓 某元素溶於金屬液成為冶金熔體,其溶液生成自由焓稱為溶解自由焓。由於活度有不同標準狀態,因之標準溶解自由焓根據標準態的不同而有不同值。
可以證明:①對純物質標準態,。高濃度合金熔體,熔渣(以氧化物為組分)等通常採用純物質標準態。②對重量1%濃度溶液的標準態,其標準溶解自由焓用嬸表示:
(13)
式中,M1為溶劑的分子量,M2為溶質的分子量,γ°為1%濃度標準溶液中溶質按拉烏爾定律計算的活度係數。對鐵液來說,式(13)可寫為式(14):
(14)
鐵液及鋼液通常採用重量 1%濃度溶液的標準態。③對1%摩爾濃度溶液的標準態,其標準溶解自由焓用嬸(摩)表示:
(15)
有色金屬的熔體多採用 1%摩爾濃度溶液的標準態。兩種1%濃度溶液的標準溶解自由焓的相互轉換關係式為:
(16)
化學反應的標準自由焓 根據參加反應的物質的標準生成自由焓及標準溶解自由焓按式(17)計算(單質的標準生成自由焓):
(17)
或更通用的表達式為:
(18)
顯然,在式(18)中,反應方程式右方的產物採用正號,而左方的反應物採用負號。對於有溶液參加的反應,由於標準溶解自由焓有不同標準態而有不同值,算出的反應標準自由焓ΔG°也有不同值,但無論採取任何標準態,利用等溫方程式在給定條件下計算的自由焓ΔG是相同的。按上列方法算出的反應標準自由焓是多項式。利用回歸分析法可求出常用的二項式,用以繪製各種化合物(氧化物、硫化物、氯化物、氟化物、碳化物、氮化物等)的以Ellingham-Richardson命名的對T 關係圖 (見氧勢圖)。為了便於運算,已有專門書籍將各單質及各種化合物不同溫度的H、Cp、S、G 等按表列出。任何冶金過程及反應的上列有關熱力學函數的變數均可按類似的通用表達式(18)進行計算。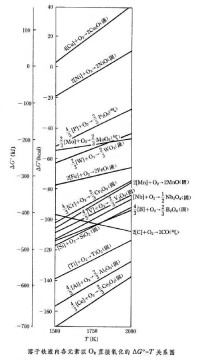 自由焓的應用 冶金反應經常是有多相參加的反應。改變自由焓是控制冶金反應方向及平衡態的手段。通過改變四個因素,即①溫度、②活度、③壓力及④添加劑可以變更反應自由焓,由正變負,由大變小,從而可選擇地使某些反應優先進行,某些反應推遲進行,或創造條件使不能進行的反應可以進行,以達到預期結果。當反應達到平衡時,利用平衡常數可以調整產物的組成。
自由焓的應用 冶金反應經常是有多相參加的反應。改變自由焓是控制冶金反應方向及平衡態的手段。通過改變四個因素,即①溫度、②活度、③壓力及④添加劑可以變更反應自由焓,由正變負,由大變小,從而可選擇地使某些反應優先進行,某些反應推遲進行,或創造條件使不能進行的反應可以進行,以達到預期結果。當反應達到平衡時,利用平衡常數可以調整產物的組成。

自由焓
由等溫方程式可理解,改變反應進行時的溫度、壓力或參加物質的活度(或三種因素同時改變),可改變反應自由焓。添加劑的作用可用碳作為添加劑對高鈦渣(或金紅石)氯化時自由焓的變化加以說明。難以進行的式(19)通過加入碳作添加劑變為極易進行的式(20):
(19)
(20)
利用化合物生成自由焓數據繪製的Ellingham-Ric-hardson圖,直接示出同類化合物穩定性大小的相對次序,給出氧化-還原的轉化溫度,為研究和分析同類型化學反應的相互關係提供依據。溶於鐵液內各元素以直接氧化的ΔG°對T的關係見圖,用以研究分析:①鍊鋼過程中雜質元素氧化的先後順序;②進行元素選擇性氧化的可能性和條件;③元素脫氧能力強弱的比較;④電弧爐鍊鋼時合金元素加入的先後順序等等。其他如焙燒、氯化等過程都可運用類似的生成自由焓對溫度的關係圖進行綜合分析。Ellingham-Richardson圖一般用標準生成自由焓ΔG°繪出,但對實際生產問題則必須利用等溫方程式具體計算出的自由焓ΔG進行分析。
T(焦)
參考書目
魏壽昆:《冶金過程熱力學》,第12章,上海科學技術出版社,1980。