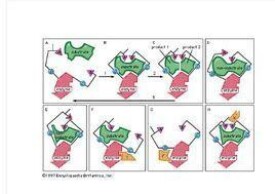
誘導契合學說
有關酶和底物結合的學說
生物反應中,酶和底物結合時,底物的結構和酶的活動中心的結構十分吻合,就好像一把鑰匙配一把鎖一樣。酶的這種互補形狀,使酶只能與對應的化合物契合,從而排斥了那些形狀、大小不適合的化合物,這就是“鎖鑰學說”,是“誘導契合”學說的前身。
“誘導契合”學說指出,酶並不是事先就以一種與底物互補的形狀存在,而是在受到誘導之後才形成互補的形狀。底物一旦結合上去,就能誘導酶蛋白的構象發生相應的變化,從而使酶和底物契合而形成酶-底物絡合物,並引起底物發生反應。反應結束當產物從酶上脫落下來后,酶的活性中心又恢復了原來的構象。
“誘導契合”學說(induced fit theory)
酶對於它所作用的底物有著嚴格的選擇,只能催化一定結構或者一些結構近似的化合物,使這些化合物發生生物化學反應。有的科學家提出,酶和底物結合時,底物的結構和酶的活動中心的結構十分吻合,就好像一把鑰匙配一把鎖一樣。酶的這種互補形狀,使酶只能與對應的化合物契合,從而排斥了那些形狀、大小不適合的化合物,這就是“鎖鑰學說”。
科學家後來發現,當底物與酶結合時,酶分子上的某些基團常常發生明顯的變化。另外,酶常常能夠催化同一個生化反應中正逆兩個方向的反應。因此,“鎖和鑰匙學說”把酶的結構看成是固定不變的,這是不符合實際的。於是,有的科學家又提出,酶並不是事先就以一種與底物互補的形狀存在,而是在受到誘導之後才形成互補的形狀。這種方式如同一隻手伸進手套之後,才誘導手套的形狀發生變化一樣。底物一旦結合上去,就能誘導酶蛋白的構像發生相應的變化,從而使酶和底物契合而形成酶-底物絡合物,這就是1958年D.E.Koshland提出的“誘導契合學說”:酶分子活性中心的結構原來並非和底物的結構互相吻合,但酶的活性中心是柔軟的而非剛性的。當底物與酶相遇時,可誘導酶活性中心的構象發生相應的變化,有關的各個基團達到正確的排列和定向,從而使酶和底物契合而結合成中間絡合物,並引起底物發生反應。反應結束當產物從酶上脫落下來后,酶的活性中心又恢復了原來的構象。
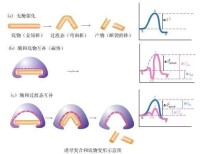
酶-底物變形與契合示意圖