單線態氧
單線態氧
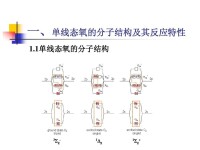
單線態氧,即激發態氧分子。基態氧原子(三線態氧分子)被激發后,原本兩個2pπ*軌道中兩個自旋平行的電子,既可以同時佔據一個2pπ*軌道,自旋相反,也可以分別佔據兩個2pπ*軌道,自旋相反。兩種激發態,S=0,2S+1=1,即他們的自旋多重性均為1,是單重態(分別用1Δg和1Σg+表示)。因此,激發態氧分子又稱為單線態氧1O2。
| 電子態 | π*2p 軌道電子排布 | 符號 | 高出基態的能量/kJ·mol-1 |
| 第二激發態(單線態) | ↑ ↓ | Σ(O) | 154.8 |
| 第一激發態(單線態) | ↑ ↓ | Δg(O) | 92.0 |
| 基態(三線態) | ↑ ↑ | Σ (O) |
1ΔgO2:10^-6s~10^-5s
1Σg+O2:10^-9s
1ΔgO2>>1Σg+O2,因此通常說的單線態氧就是1Δg。
單線態氧的壽命與其所處環境密切相關,在氣體環境室溫下,可達到1小時以上(有報道為72 分鐘),而在溶液不同溶液中壽命不同。
單線態氧在不同溶劑中的壽命:
| 溶劑 | τ(1Ο2)/μs |
| 水 | 2 |
| 乙醇 | 10 |
| 環己烷 | 16 |
| 正丁醇 | 19 |
| 重水 | 20 (32) |
| 苯 | 24 |
| 丙酮 | 25 |
| 重氫丙酮 | 25 |
| 乙腈 | 30 |
| 吡啶 | 33 |
| 叔丁醇 | 34 |
| 氯仿 | 60 |
| 二硫化碳 | 200 |
| 六氟苯 | 600 |
| 四氯化碳 | 700 |
| 氟利昂Ⅱ(CF3Cl) | 1000 |
基態氧分子吸收光直接產生1O2是不可能的,躍遷高度禁阻。可以通過光敏化法、微波放電法和化學方法得到。
1.光敏化法就是在光敏化劑作用下對基態氧進行輻照。常用的光敏化劑是一種熒光性染料(如熒光黃、亞甲基藍、葉綠素等),可表示為:
敏化劑----hv--->敏化劑T1
敏化劑T1+O2(基)----能量傳遞--->敏化劑+1O2
2.化學反應製備:H2O2+ClO- ----EtOH--->1O2+H20+Cl-
1.主要是1,2-、1,3-及1,4-烯烴的加成:
R2C=CR`2+1O2----->---hv或△--->R2CO+R`2CO
2.1O2在體內會不斷生成與猝滅,並且在多種生理及病理過程中起作用(包括好的和壞的)。例如,在染料光敏化氧化條件下,各種生物成分(蛋白質、氨基酸、核酸等)很容易與氧反應而使有機體損壞,如在動物和人體中會引起蛋白質光氧化疾病等。
單線態氧