熱力學三大定律
能量守恆定律
熱力學第一定律是能量守恆定律。熱力學第二定律有幾種表述方式:克勞修斯表述為熱量可以自發地從溫度高的物體傳遞到溫度低的物體,但不可能自發地從溫度低的物體傳遞到溫度高的物體。
爾文-普朗克表述為不可能從單一熱源吸取熱量,並將這熱量完全變為功,而不產生其他影響。以及熵增表述:孤立系統的熵永不減小。熱力學第三定律通常表述為絕對零度時,所有純物質的完美晶體的熵值為零,或者絕對零度(T=0K)不可達到。
熱力學第一定律也就是能量守恆定律。自從焦耳以無以辯駁的精確實驗結果證明機械能、電能、內能之間的轉化滿足守恆關係之後,人們就認為能量守恆定律是自然界的一個普遍的基本規律。
內容
一個熱力學系統的內能增量等於外界向它傳遞的熱量與外界對它所做的功的和。(如果一個系統與環境孤立,那麼它的內能將不會發生變化。)
表達式:
考慮有粒子交換的情況下
符號規律
:熱力學第一定律的數學表達式也適用於物體對外做功,向外界散熱和內能減少的情況,因此在使用:△U=-W+Q時,通常有如下規定:
①系統對外界做功,W>0,即W為正值。
②外界對系統做功,W<0,即W為負值。
③系統從外界吸收熱量,Q>0,即Q為正值
④系統對外界放出熱量,Q<0,即Q為負值
⑤系統內能增加,△U>0,即△U為正值
⑥系統內能減少,△U<0,即△U為負值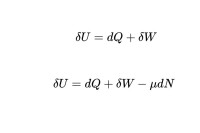
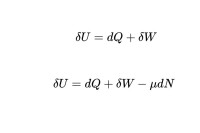
熱力學三大定律
理解
從三方面理解
1.如果單純通過做功來改變物體的內能,內能的變化可以用做功的多少來度量,這時系統內能的增加(或減少)量△U就等於外界對物體(或物體對外界)所做功的數值,即△U=W
2.如果單純通過熱傳遞來改變物體的內能,內能的變化可以用傳遞熱量的多少來度量,這時系統內能的增加(或減少)量△U就等於從外界吸收(或對外界放出)熱量Q的數值,即△U=Q
3.在做功和熱傳遞同時存在的過程中,系統內能的變化,則要由做功和所傳遞的熱量共同決定。在這種情況下,系統內能的增量△U就等於從外界吸收的熱量Q和外界對系統做功A之和。即△U=W+Q
能量守恆定律
能量既不能憑空產生,也不能憑空消失,它只能從一種形式轉化為另一種形式,或者從一個物體轉移到另一個物體,在轉移和轉化的過程中,能量的總量不變。
能量的多樣性
不同形式的能量轉化
“摩擦生熱”是通過克服摩擦力做功將機械能轉化為內能;水壺中的水沸騰時水蒸氣對壺蓋做功將壺蓋頂起,表明內能轉化為機械能;電流通過電熱絲做功可將電能轉化為內能……這些實例說明了不同形式的能量之間可以相互轉化,且這一轉化過程是通過做功來完成的。
能量守恆的意義
1.能的轉化與守恆是分析解決問題的一個極為重要的方法,它比機械能守恆定律更普遍。例如物體在空中下落受到阻力時,物體的機械能不守恆,但包括內能在內的總能量守恆。
2.能量守恆定律是19世紀自然科學中三大發現之一,也莊重宣告了第一類永動機幻想的徹底破滅。
3.能量守恆定律是認識自然、改造自然的有力武器,這個定律將廣泛的自然科學技術領域聯繫起來。
第一類永動機
第一類永動機是不消耗任何能量卻能源源不斷地對外做功的機器。
其不可能存在,因為違背了能量守恆定律
熱力學第二定律有幾種表述方式:
克勞修斯表述:熱量可以自發地從溫度高的物體傳遞到較冷的物體,但不可能自發地從溫度低的物體傳遞到溫度高的物體;
開爾文-普朗克表述:不可能從單一熱源吸取熱量,並將這熱量完全變為功,而不產生其他影響。
熵表述:隨時間進行,一個孤立體系中的熵不會減小。
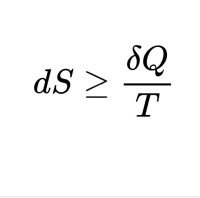
熱力學三大定律
熱力學第二定律的兩種表述(前2種)看上去似乎沒什麼關係,然而實際上他們是等效的,即由其中一個,可以推導出另一個。
熱力學第二定律的每一種表述,都揭示了大量分子參與的宏觀過程的方向性,使人們認識到自然界中進行的涉及熱現象的宏觀過程都具有方向性。
熱力學第二定律的英文解釋是熵是趨向於總體增大,比如1L90度水(A)和1L10度水(B)融合,不會是A的溫度增加而 B的溫度減小,因為如此的話,總體的熵減小。如果A溫度降但B溫度升高一點,其總體的熵增加。
一切自然過程總是沿著分子熱運動的無序性增大的方向進行。
第二類永動機(不可能製成)
只從單一熱源吸收熱量,使之完全變為有用的功而不引起其他變化的熱機。
因為第二類永動機效率為100%,雖然它不違反能量守恆定律,但大量事實證明,在任何情況下,熱機都不可能只有一個熱源,熱機要不斷地把吸取的熱量變成有用的功,就不可避免地將一部分熱量傳給低溫物體,因此效率不會達到100%。第二類永動機違反了熱力學第二定律。
熱力學第三定律通常表述為絕對零度時,所有純物質的完美晶體的熵值為零。或者絕對零度(T=0K即-273.15℃)不可達到。
R.H.否勒和E.A.古根海姆還提出熱力學第三定律的另一種表述形式:任何系統都不能通過有限的步驟使自身溫度降低到0K,稱為0K不能達到原理。

熱力學三大定律
熱力學第零定律:如果兩個熱力學系統均與第三個熱力學系統處於熱平衡,那麼它們也必定處於熱平衡。也就是說熱平衡是傳遞的。
熱力學第零定律是熱力學三大定律的基礎,它定義了溫度。
(因為在三大定律之後,人類才發現其重要性,故稱為“第零定律”)
在熱力學定律中:
第零定律給出了溫度T的定義;
第一定律給出了能量守恆的關係;
第二定律給出了熵增原理;
第三定律告訴人們絕對零度無法達到。
結合以上定律和公式,可以得出熱力學基本方程:
