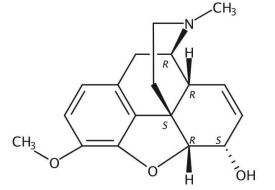
可待因
鎮咳葯
可待因,化學式為C18H21NO3,是一種鴉片類藥物,適用於:①各種原因引起的劇烈乾咳和刺激性咳嗽,尤適用於伴有胸痛的劇烈乾咳。由於可待因能抑制呼吸道腺體分泌和纖毛運動,故對有少量痰液的劇烈咳嗽,應與祛痰葯並用。②可用於中等度疼痛的鎮痛。③局部麻醉或全身麻醉時的輔助用藥,具有鎮靜作用。
2018年9月4日,為進一步保障公眾用藥安全,國家藥品監督管理局決定對含可待因感冒藥說明書“禁忌”“兒童用藥”項進行修訂。其中,“禁忌症”中相關內容修訂為“18歲以下青少年兒童禁用”,“兒童用藥”中相關內容修訂為“18歲以下青少年兒童禁用本品”。
熔點:154-156℃
沸點:462℃
密度:1.34g/cm
閃點:75℃
計算化學數據
1.疏水參數計算參考值(XlogP):無
2.氫鍵供體數量:1
3.氫鍵受體數量:4
4.可旋轉化學鍵數量:1
5.互變異構體數量:0
6.拓撲分子極性表面積:41.9
7.重原子數量:22
8.表面電荷:0
9.複雜度:509
10.同位素原子數量:0
11.確定原子立構中心數量::5
12.不確定原子立構中心數量:0
13.確定化學鍵立構中心數量:0
14.不確定化學鍵立構中心數量:0
15.共價鍵單元數量:1
能直接抑制延腦的咳嗽中樞,止咳作用迅速而強大,其作用強度約為嗎啡的1/4。也有鎮痛作用,約為嗎啡的1/12~1/7,但強於一般解熱鎮痛葯。其鎮痛、呼吸抑制、便秘、耐受性及成癮性等作用均較嗎啡弱。口服吸收快而完全,其生物利用度為40%~70%。一次口服后,約1小時血葯濃度達高峰,t1/2約為3~4小時。易於透過血腦屏障及胎盤,主要在肝臟與葡萄糖醛酸結合,約15%經脫甲基變為嗎啡。其代謝產物主要經尿排泄。
由於劑型及規格不同,用法用量請仔細閱讀藥品說明書或遵醫囑。
一次口服劑量超過60mg時,一些患者可出現興奮,煩躁不安、瞳孔縮小、呼吸抑制、低血壓、心率過緩。小兒過量可致驚厥,可用納洛酮對抗。亦可見噁心、嘔吐、便秘及眩暈。
18歲以下青少年兒童禁用。
①長期應用亦可產生耐受性、成癮性。②妊娠期應用本品可透過胎盤使胎兒成癮,引起新生兒戒斷癥狀,如腹瀉、嘔吐、打哈欠、過度啼哭等。分娩期應用可致新生兒呼吸抑制。③緩釋片必須整片吞服,不可嚼碎或掰開。
(1)本品與抗膽鹼葯合用時,可加重便秘或尿瀦留的不良反應。(2)與美沙酮或其他嗎啡類中樞抑製藥合用時,可加重中樞性呼吸抑制作用。(3)與肌肉鬆弛葯合用時,呼吸抑制更為顯著。(4)本品抑制齊多夫定代謝,避免二者合用。(5)與甲喹酮合用,可增強本品的鎮咳和鎮痛作用。(6)本品可增強解熱鎮痛葯的鎮痛作用。(7)與巴比妥類藥物合用,可加重中樞抑制作用。(8)與西咪替丁合用,可誘發精神錯亂,定向力障礙及呼吸急促。
片劑:15mg、30mg
【鑒別】(1)取本品約0.2g,加水4mL溶解后,在不斷攪拌下滴加20%氫氧化鈉溶液至出現白色沉澱,用玻璃棒摩擦器壁使沉澱完全,過濾;沉澱用水洗凈,在105℃乾燥1小時,依法測定(附錄ⅥC),熔點為154~158℃。(2)取本品約0.1g,加水5mL溶解后,滴加氨試液使成鹼性,不得生成沉澱。(3)取本品約1mg,置白瓷板上,加含亞硒酸2.5mg的硫酸0.5mL,立即顯綠色,漸變藍色。(4)本品的紅外光吸收圖譜應與對照的圖譜(光譜集92圖)一致。(5)本品的水溶液顯磷酸鹽的鑒別反應(附錄Ⅲ)。
【檢查】酸度
取本品0.4g,加水10mL溶解后,依法測定(附錄ⅥH),pH值應為4.0~5.0。溶
液的澄清度與顏色
取本品0.4g,加新沸過的冷水10mL溶解后,溶液應澄清無色;如顯渾濁,與1號濁度標準液(附錄ⅨB)比較,不得更濃;如顯色,與黃色2號標準比色液(附錄ⅨA第一法)比較,不得更深。
氣化物
取本品0.10g,依法檢查(附錄ⅧA),與標準氯化鈉溶液5.0mL製成的對照液比較,不得更濃(0.05%)。
硫酸鹽
取本品0.20g,依法檢査(附錄ⅧB),如發生渾濁,與標準硫酸鉀溶液2.0mL製成的對照液比較,不得更濃(0.1%)。
有關物質
取本品,精密稱定,加流動相溶解並稀釋製成每1mL中含10mg的溶液作為供試品溶液;另取嗎啡對照品,精密稱定,用流動相溶解並稀釋製成每1mL中含1mg的溶液作為對照品溶液;精密量取供試品溶液0.2mL與對照品溶液1mL,置同一100mL量瓶中,用流動相稀釋至刻度,搖勻,作為對照溶液。照髙效液相色譜法(附錄VD)試驗,用十八烷基硅烷鍵合硅膠為填充劑;以0.03mol/L醋酸鈉溶液(用冰醋酸調節pH值至3.5)-甲醇(60:10)為流動相;檢測波長為230nm;理論板數按磷酸可待因峰計箅不低於2000,嗎啡峰與磷酸可待因峰的分離度應符合要求。取對照溶液10μL注入液相色譜儀,調節檢測靈敏度,使主成分色譜峰的峰高約為滿量程的20%。再精密量取供試品溶液和對照溶液各10μL,分別注入液相色譜儀,記錄色譜圖至主成分峰保留時間的3倍,供試品溶液的色譜圖中如有與嗎啡峰保留時間一致的色譜峰,其峰面積不得大於對照溶液中嗎啡峰面積(0.1%);其他單個雜質的峰面積不得大於對照溶液中磷酸可待因峰面積的2.5倍(0.5%);各雜質峰面積的和不得大於對照溶液中磷酸可待因峰面積的5倍(1.0%)。
乾燥失重
取本品,在105℃乾燥至恆重,減失重量應為5.0%~7.5%(附錄ⅧL)。
【含量測定】取本品約0.25g,精密稱定,加冰醋酸10mL溶解后,加結晶紫指示液1滴,用髙氯酸滴定液(0.1mol/L)滴定至溶液顯綠色,並將滴定的結果用空白試驗校正。每1mL高氯酸滴定液(0.1mol/L)相當於39.74mg的C18H21NO3·H3PO4
【類別】鎮痛葯,鎮咳葯。
【貯藏】遮光,密封保存。
全文如下
為進一步保障公眾用藥安全,國家藥品監督管理局決定對含可待因感冒藥說明書【禁忌】、【兒童用藥】項進行修訂。現將有關事項公告如下:
一、所有含可待因感冒藥藥品生產企業均應當依據《藥品註冊管理辦法》等有關規定,按照含可待因感冒藥藥品說明書修訂要求(見附件),提出修訂說明書的補充申請,於2018年11月5日前報省級藥品監管部門備案。
修訂內容涉及藥品標籤的,應當一併進行修訂;說明書及標籤其他內容應當與原批准內容一致。在補充申請備案后6個月內對已出廠的藥品說明書及標籤予以更換。
各含可待因感冒藥藥品生產企業應當對新增不良反應發生機制開展深入研究,採取有效措施做好使用和安全性問題的宣傳培訓,指導醫師合理用藥。
二、臨床醫師應當仔細閱讀含可待因感冒藥藥品說明書的修訂內容,在選擇用藥時,應當根據新修訂說明書進行充分的效益/風險分析。
三、患者應當嚴格遵醫囑用藥,用藥前應當仔細閱讀說明書。
四、請省級藥品監管部門在日常監管中督促企業做好有關產品說明書修改和標籤說明書更換工作。
特此公告。
附件:含可待因感冒藥藥品說明書修訂要求
國家藥品監督管理局
2018年9月4日