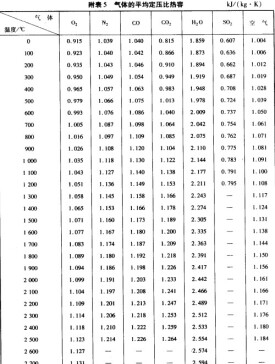
定壓比熱容
定壓比熱容
在壓強不變的情況下,單位質量的某種物質溫度升高1K所需吸收的熱量,叫做該種物質的定壓比熱容,用符號Cp表示,國際制單位是:J/(kg·K)。對於同種氣體,定壓比熱容一般比定容比熱容大。
定義:單位質量的物質在定壓的條件下溫度升高1K時比熱力學能增加的數值。比熱力學能是物質的狀態參數,因此,定壓比熱容也是僅和物質狀態有關的熱力學參數。
按照比熱容的定義,在可逆過程中,可得到定壓比熱容的表示式為:
定壓比熱容
根據熱力學第一定律的能量方程式及比焓的全微分關係,可得出定壓比熱容的表示式為:
定壓比熱容
定壓比熱容