濃差極化
膜分離過程中的現象
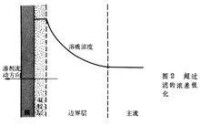
濃差極化是指分離過程中,料液中的溶液在壓力驅動下透過膜,溶質(離子或不同分子量溶質)被截留,在膜與本體溶液界面或臨近膜界面區域濃度越來越高;在濃度梯度作用下,溶質又會由膜面向本體溶液擴散,形成邊界層,使流體阻力與局部滲透壓增加,從而導致溶劑透過通量下降。
① 膜分離過程中的一種現象,會降低透水率,是一個可逆過程。是指在 超濾過程中,由於水透過膜而使膜表面的 溶質濃度增加,在 濃度梯度作用下,溶質與水以相反方向向本體 溶液擴散,在達到 平衡狀態時,膜表面形成一溶質濃度分佈 邊界層,它對水的透過起著 阻礙作用。
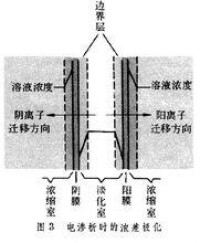
② 電流通過電池或 電解池時,如整個 電極過程為 電解質的擴散和對流等過程所控制,則在 兩極附近的電解質 濃度與溶液本體就有差異,使 陽極和 陰極的 電極電位與 平衡電極電位發生偏離,這種現象稱為“濃差極化”。
濃差極化會使實際的產水通量和脫鹽率低於理論估算值。濃差極化效應如下:
膜表面上的滲透壓比本體溶液中高,從而降低NDP;
降低水通量(Qw);
增加透鹽量(Qs);
濃差極化
化因子(β)被定義為膜表面鹽濃度(Cs)與本體溶液鹽濃度(Cb)的比值:
那麼哪些參數會影響濃差極化因子(β)呢?通常產水通量的增加會增加邊
界層的鹽濃度,從而增加Cs;而給水流量的增加會增大膜表面流速,削減邊界層的厚度。因此 β 值與產水流量(Qp)成正比,與平均進水流量(Qfavg)成反比:式中:Kp —— 比例常數,其值取決於反滲透系統的構成方式。平均進水流量採用進水量和濃縮液流量的算術平均值,β 值可以進一步表達為膜元件透過液回收率的函數:美國海德能公司推薦的一級反滲透系統濃差極化因子極限值為1.20,對於一支40英寸長的膜元件來說,大約相當於18 %的回收率。對於雙級反滲透系統的第二級,由於其進水含鹽量已經顯著降低,因此其 β 值可以適當放寬到1.40,在某些情況下可以容忍到1.70。
電解過程中溶液在電解槽內出現的這種濃度差異,是由於液相傳質即,通過界面層溶液的擴散速度跟不上電解速度引起的。結果,當電極反應在一定電流密度下達到穩定后,陰極界面層溶液的濃度必低於本體溶液;而在陽極,例如可溶陽極,界面層溶液的濃度必高於本體溶液。根據能斯特(w.Nernst)電位方程,這兩種情況都要導致電極電位偏離按本體溶液濃度計的平衡電位:陰極電勢變小(向負方向移動),陽極電勢變大(向正方向移動),即發生了電極的濃差極化。
濃差極化隨電流密度增加而增大。濃差極化是大電流密度下產生的主要極化形式。濃差極的大小用濃差超電位釹£表示,陰極濃差超電位與電流密度i的關係為:
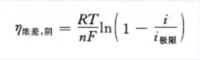
濃差極化
濃差極化對金屬電解、電鍍沒有任何好處,它使槽電壓升高,電耗增大,並使陰極沉積或鍍層質量惡化,甚至造成氫的析出和雜質金屬離子的放電。濃差極化可以通過攪拌、加熱溶液或移動電極而消除至一定限度,但由於電極表面擴散層的存在而不能完全避免。