限制性片段長度多態性
限制性片段長度多態性
限制性片段長度多態性(restriction fragment length polymorphism,RF LP )簡稱PCR-RFLP 分析。它主要是設計適當的擴增引物,使擴增片段包括某一一個或數個多態性的限制性內切酶識別序列,在PCR 擴增後用該限制酶切割PCR 產物,根據電泳后酶切(Amp-FLP) 對VNTR.STR 等重複序列,因重複單位數目的不同而呈現高度多態。因此利用重複序列兩側的特異性引物進行PCR 擴增,所得擴增片段具有高度多態性,這些不同長度的等位片段可用PAGE 分離。
限制性片段長度多態性(restriction fragment length polymorphism,縮寫RFLP) 技術的原理是檢測DNA在限制性內切酶酶切后形成的特定DNA片段的大小。因此凡是可以引起酶切位點變異的突變如點突變(新產生和去除酶切位點)和 一段DNA的重新組織(如插入和缺失造成酶切位點間的長度發生變化)等均可導致RFLP的產生。
RFLP技術於1980年由人類遺傳學家Bostein提出。它是第一代DNA分子標記技術。Donis—Keller利用此技術於1987年構建成第一張人的遺傳圖譜。DNA分子水平上的多態性檢測技術是進行基因組研究的基礎。RFLP(Restriction Fragment Length Polymorphism,限制片段長度多態性)已被廣泛用於基因組遺傳圖譜構建、基因定位以及生物進化和分類的研究。RFLP是根據不同品種(個體)基因組的限制性內切酶的酶切位點鹼基發生突變,或酶切位點之間發生了鹼基的插入、缺失,導致酶切片段大小發生了變化,這種變化可以通過特定探針雜交進行檢測,從而可比較不同品種(個體)的DNA水平的差異(即多態性),多個探針的比較可以確立生物的進化和分類關係。所用的探針為來源於同種或不同種基因組DNA的克隆,位於染色體的不同位點,從而可以作為一種分子標記(Mark),構建分子圖譜。
當某個性狀(基因)與某個(些)分子標記協同分離時,表明這個性狀(基因)與分子標記連鎖。分子標記與性狀之間交換值的大小,即表示目標基因與分子標記之間的距離,從而可將基因定位於分子圖譜上。分子標記克隆在質粒上,可以繁殖及保存。不同限制性內切酶切割基因組DNA后,所切的片段類型不一樣,因此,限制性內切酶與分子標記組成不同組合進行研究。常用的限制性內切酶一般是HindⅢ,BamHⅠ,EcoRⅠ,EcoRV,XbaⅠ,而分子標記則有幾個甚至上千個。分子標記越多,則所構建的圖譜就越飽和。構建飽和圖譜是 RFLP 研究的主要目標之一。
該技術是利用限制性內切酶能識別DNA分子的特異序列,並在特定序列處切開DNA分子,即產生限制性片段的特性,對於不同種群的生物個體而言,他們的DNA序列存在差別。如果這種差別剛好發生在內切酶的酶切位點,並使內切酶識別序列變成了不能識別序列或是這種差別使本來不是內切酶識別位點的DNA序列變成了內切酶識別位點。這樣就導致了用限制性內切酶酶切該DNA序列時,就會少一個或多一個酶切位點,結果產生少一個或多一個的酶切片段。這樣就形成了用同一種限制性內切酶切割不同物種DNA序列時,產生不同長度大小、不同數量的限制性酶切片段。后將這些片段電泳、轉膜、變性,與標記過的探針進行雜交,洗膜,即可分析其多態性結果。
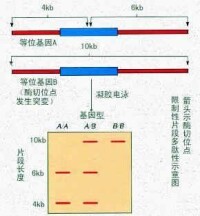
限制性片段長度多態性
一類是由於限制性內切酶位點上發生了單個鹼基突變而使這一限制性位點發生丟失或獲得而產生的多態性,故稱之為點多態性(point polymorphism )。這類多態性實際上是雙態的,即有(+ )或無(- )。另一類是由於DNA 分子內部發生較大的順序變化所致。這一類多態性又可以分成兩類:第一類是由於DNA 順序上發生突變如缺失、重複、插入所致。第二類是近年發現的所謂“高變區”。高變區(highly variable region ),是由多個串聯重複順序組成的,不同的個體高變區內所串聯重複的拷貝數相差懸殊,因而高變區的長度變化很大,從而使高變區兩側限制性內切酶識別位點的固定位置隨高變區的大小而發生相對位移。所以這一類型的RFLP 是由於高變區內串聯重複順序的拷貝數不同所產生的,其突出特徵是限制性內切酶識別位點本身的鹼基沒有發生改變,改變的只是它在基因組中的相對位置。實際上,在DNA 順序中,存在著大量的單個鹼基的替換,但用通常所用的技術只能檢測出影響到限制性內切酶識別位點上的突變。
不同的多態性切點在一特定人群中出現(+ )的頻率不一樣。如在一段DNA 中,切點A出現的頻率為0.6 (即60 %的人含有該切點,而另外40 %的人在同一位點處不含該切點);而切點B的出現的頻率為0.4 。如果這兩個多態性切點(A,B)是隨機相關的,那麼,A、B同時存在(++ )的概率等於每個位點存在頻率的乘積,即0.6 ×0.4=0.24, 即24 %的人同時含有A、B兩個切點。如果它們是非隨機相關的,那麼同時存在的可能性將和預期的頻率相差較大。這種相關的非隨機性稱為連鎖不平衡。如果多態性切點數目為n ,則可有 2的N次方種不同的組合,每種組合稱為一種單體型(haplotype ),每種單體型隨機相關的預期出現頻率為各個位點頻率乘積。但是,實踐證明多態性切點之間並非隨機相關。例如,在β珠蛋白基因簇內多態性切點2 到9 共8 個,理論應有256 種組合,即256 種單體型。但實際上只有3 種單體型,其中在希臘、義大利和亞洲印度人身上βA 染色體(攜帶正常β-珠蛋白基因的染色體)就佔有94 %,而有些理論上的組合在實際上卻是不存在的。在理論上,單體型(從切點2 到9 )的頻率為0.46 ×0.48 ×0.7 ×0.27 ×0.83 ×0.52 ×0.37 ×0.32=0.0021, 而實際上該單體型的頻率為0.64 ,兩者相差甚大。這說明各個多態性切點之間是非隨機相關的(連鎖不平衡)。但也有例外,如切點10(HinfI 切點)與β基因簇各個切點都是連鎖平衡的。從單體型與疾病基因的關係的研究發現,某一β-地中海貧血(簡稱β-地貧)基因在某一人群中與某些單體型存在著強烈的相關性,並且只有少數例外的情況。這樣,在該人群中,只要我們確定了某個人的單體型就可以基本上確定該個體是否含有某種突變基因。
但是,即使在同一種族的人群或同一區域的人群中,這種連鎖仍是不完全的。這主要表現在兩個方面:第一,某一RFLP 單體型與某一突變基因相連鎖,但在正常人中也能找到相同的單體型。因此,應用單體型就不能肯定地說某一個體是否存在該突變基因。但是,即使在同一種族的人群中或同一區域中的人群中,這種連鎖也不相同。因此, 應用單體型就不能肯定地說某一個體是否存在該突變基因。第二、同一種突變也可以和幾種單體型相關聯。對於這兩個情況,為了進行產前診斷,可以先通過家系調查,確定在該家系中某種單體型確與某種突變基因相關聯后,再檢測胎兒的單體型來確定該胎兒是還含有這種突變基因。但有時通過家系調查也無法確定某種單體型是否與某種突變相連鎖,這時,就無法對其胎兒作出正確的判斷。這也是RFLP 用於診斷的缺點所在。
高變區DNA與DNA指紋
人的衛星DNA 或稱隨體DNA 是由一些短的DNA 片段(10bp 左右)多次重複所構成的。重複片段的組成和拷貝數在不同的個體及基因組的不同位置上不一樣。提取不同個體的基因組DNA 后,用其切點能識別序列為4 個鹼基而又不切割該重複片段的限制性內切酶在重複片段的兩側切割基因組DNA ,然後將樣品進行凝膠電泳。不同長度的重複片段(主要是由於重複單位的拷貝數不同所致)就會分開,再與含有這些重複序列的特異性探針雜交,便形成有個體特異性的放射性自顯影圖,亦稱為DNA 指紋。
DNA 指紋的圖譜

限制性片段長度多態性
