硼替佐米
硼替佐米
硼替佐米(Bortezomib),為黃色固體的化學品,商品名:萬珂® VELCADE®,中文別名:MG-341;硼替佐米雜質;保特佐米,熔點:122-124°C,分子式 :C19H25BN4O4,分子量 :384.23700,本品可聯合美法侖和潑尼松(MP方案)用於既往未經治療的且不適合大劑量化療和骨髓抑制的多發性骨髓瘤患者的治療;或單藥用於至少接受過一種或一種以上治療后複發的多發性骨髓瘤患者的治療;本品可用於複發或難治性套細胞淋巴瘤患者的治療,此患者在使用本品前至少接受過一種治療。用於該適應症的安全有效性數據來自國外一項針對既往治療后複發的套細胞淋巴瘤的單臂Ⅱ期臨床研究,尚缺乏針對中國人群的臨床研究數據。
中文名:硼替佐米
英文名:Bortezomib
中文別名:MG-341;
硼替佐米雜質;
保特佐米;
PS-341;
N-(2-吡嗪羰基)-L-苯丙氨酸-L-亮氨酸硼酸;
英文別名:VELCADE;
Radiciol;
MG-341 PS-341;
Bortezmib;
Bortezomib Base;
Bortezomib;
CAS號:179324-69-7
分子式:C19H25BN4O4
分子量:384.23700
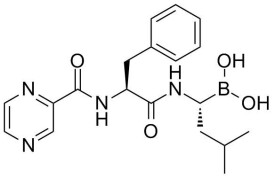
化學結構式:
PSA:124.44000
LogP:1.56230
外觀與性狀:黃色固體
密度:1.214
熔點:122-124°C
折射率:1.564
海關編碼:2934999090
危險品運輸編碼:3261
安全說明:S26-S36/37/39
中國海關編碼:2934999090
概述:
2934999090. 其他雜環化合物. 增值稅率:17.0%. 退稅率:13.0%. 監管條件:無. 最惠國關稅:6.5%. 普通關稅:20.0%
申報要素:
品名, 成分含量, 用途
通用名稱: 注射用硼替佐米
商品名稱: 萬珂® VELCADE®
英文名稱: Bortezomib for Injection
漢語拼音:Zhu She Yong Peng Ti Zuo Mi
化葯及生物製品>>治療腫瘤的藥物>>抗腫瘤藥物>>其他抗腫瘤葯
本品為白色或類白色塊狀物或粉末。
多發性骨髓瘤
本品可聯合美法侖和潑尼松(MP方案)用於既往未經治療的且不適合大劑量化療和骨髓抑制的多發性骨髓瘤患者的治療;或單藥用於至少接受過一種或一種以上治療后複發的多發性骨髓瘤患者的治療。
套細胞淋巴瘤
本品可用於複發或難治性套細胞淋巴瘤患者的治療,此患者在使用本品前至少接受過一種治療。用於該適應症的安全有效性數據來自國外一項針對既往治療后複發的套細胞淋巴瘤的單臂Ⅱ期臨床研究(見【臨床試驗】),尚缺乏針對中國人群的臨床研究數據。
(1)1.0mg(2)3.5mg
本品僅用於靜脈注射給葯,鞘內注射會導致死亡。
未經治療的多發性骨髓瘤患者
本品在聯合口服美法侖和口服潑尼松進行治療時,於3~5秒內經靜脈推注。每個療程6周(如表1所示),共9個療程。在第1-4療程內,每周給予本品2次(第1、4、8、11、22、25、29和32天)。在第5-9療程內,每周給予本品1次(第1、8、22和29天)。兩次給葯至少間隔72小時。
本品與美法侖、潑尼松聯合治療的任一療程開始之前,患者應符合以下條件:
·血小板計數應≥70×10/L,ANC應≥1.0×10/L
·非血液學毒性應降至1級或基線水平
單葯
治療推薦劑量
本品的推薦劑量為單次注射1.3mg/m,每周注射2次,連續注射2周(即在第1、4、8和11天注射)后停葯10天(即從第12至第21天)。
3周為1個療程,兩次給葯至少間隔72小時。
對於超過8個療程的維持治療,可按標準方案給葯,也可以按每周1次、連續給葯4周的維持方案(第1、8、15和22天),隨後是13天的休息期(第23至35天)。
劑量調整以及重新開始治療
當發生3級非血液學的或任何4級血液學的毒性(不包括下面討論的神經病變)時,應暫停本品治療。一旦毒性癥狀的到緩解,可以重新開始本品的治療,劑量減少25%(例如:1.3mg/m降低到1.0mg/m;1.0mg/m降低到0.7mg/m)。如果患者發生與本品治療有關的神經痛或周圍感覺神經病變,建議按下表推薦的調整劑量進行治療,主治醫生應根據患者實際病情選擇合適的劑量調整方案。如果患者本身患有嚴重的神經病變,只有權衡利弊後方可使用本品。
輕度肝功能損害患者不需要調整起始劑量並應按推薦劑量治療。中重度肝功能損害患者使用本品的起始劑量應降為0.7mg/m,根據患者第一個周期的耐受性,隨後的治療劑量增加至1.0mg/m或進一步降至0.5mg/m。
輕中度腎功能不全的患者無需調整本品的劑量。由於透析會降低本品的濃度,故應該在透析結束后再給予本品。重度腎功能不全(CrCL<20mL/min/1.73m)的患者未透析時本品的葯代動力學是否受影響尚不明確。有關美法侖用於腎功能損害患者時的劑量調整信息請參考其生產者的說明書。
給藥方法
本品須用生理鹽水完全溶解后在3~5秒內通過中央靜脈導管或外周靜脈注射,隨後使用注射用0.9%氯化鈉溶液沖洗。
以下均來自國外臨床試驗的安全性信息
治療複發/難治性多發性骨髓瘤患者的臨床試驗總結
在三項臨床研究中評價了本品在推薦劑量1.3 mg/m下的療效和安全性,包括一項隨機的地塞米松對照III期試驗(M34101-039),治療669例1-3線治療后複發或難治性多發性骨髓瘤患者;一項單臂、開放性、多中心的II期試驗,治療202例曾接受過2線治療且近期發現病情惡化的患者(M34100-025);一項評價本品劑量-反應的II期臨床試驗,治療病情惡化或複發或接受過本品1.0 mg/m或1.3 mg/m1線治療的複發性多發性骨髓瘤患者(M34100-024)。
*包括死亡在內
‡一項以1.3 mg/m推薦劑量的本品治療多發性骨髓瘤的研究,患者曾接受過至少4種療法或在方案M34101-039中接受高劑量地塞米松后病情惡化
§ 包括MedDRA HLT字典中所有“周圍神經病變 NEC”的術語
治療未接受治療的多發性骨髓瘤患者的臨床試驗總結
下表列出了在一項前瞻性III期研究中,未接受過治療的340例多發性骨髓瘤患者,本品(1.3 mg/m)合用MP聯合療法【美法侖(9 mg/m)和潑尼松(60 mg/m)】的安全性數據。
在參加III期研究的未曾接受過治療的多發性骨髓瘤患者中,本品合用MP組中有27%的患者接受了抗病毒的預防性治療。在此項研究中,與MP單獨治療組相比,帶狀皰疹的複發在本品合用MP組的患者中更常見(分別為3%和11%)。本品合用MP治療組中接受了抗病毒預防性治療的91例患者中,有3例(3%)出現了帶狀皰疹的複發。
套細胞淋巴瘤患者
在一項II期臨床研究中評價了155例套細胞淋巴瘤患者接受本品的推薦劑量1.3 mg/m的安全性。本品在套細胞淋巴瘤患者中的總體安全性與在多發性骨髓瘤患者中觀察到的相似。在上述兩類患者群中明顯的區別為:雖然套細胞淋巴瘤患者出現外周神經病變、皮疹和瘙癢的報告率高於多發性骨髓瘤患者,但多發性骨髓瘤患者出現血小板減少、中性粒細胞減少、貧血、噁心、嘔吐和發熱報告率高於套細胞淋巴瘤患者。
上市后經驗
依據全球上市后本品的用藥經驗,自發報告的不良反應列於表4中。
不良反應根據發生頻率分為:很常見(≥1/10);常見(≥1/100,且<1/10);少見(≥1/1000,且<1/100);罕見(≥1/10000,且<1/1000);極罕見(<1/10000,包括個別病例)。
如下自發報告的不良反應數據並不能精確評價在臨床試驗和流行病學研究中得出的發生率。並不代表臨床試驗或流行病學研究中所示的真實發生率。
對硼替佐米、硼或者甘露醇過敏的患者禁用。
應在有抗腫瘤藥物使用經驗的醫生監督下使用,且應在使用本品的過程中頻繁地監測全血細胞計數(CBC)。本品為抗腫瘤藥物,配製時應小心,戴手套操作以防皮膚接觸。
本品曾有因不慎的鞘內注射兒致死亡的案例報告。因此,本品僅用於靜脈注射,嚴禁鞘內注射。
總體上,本品單葯治療的安全性特點與聯合美法侖和潑尼松的治療方案觀察到的相似。
· 周圍神經病變
使用本品治療可能會導致周圍神經病變(PN),主要是感覺神經,但是也有伴或不伴周圍感覺運動神經病變的嚴重運動神經病變的報道。
以前就存在周圍神經病變癥狀(腳或手有麻木、疼痛或灼燒感)或周圍神經病變體征的患者在使用本品治療期間神經病變的癥狀(包括≥3級)可能加重。建議監測此類患者神經病變的癥狀,如灼燒感、感覺過敏、感覺減退、感覺異常、不適感或神經痛。在一項對比本品靜脈注射與皮下注射的Ⅲ期試驗中,皮下給葯組2級及2級以上的周圍神經病變事件的發生率為24%,靜脈給葯組為41%(p=0.0124)。皮下組3級及3級以上的周圍神經病變的發生率為6%,而靜注組為16%(p=0.0264)。因此在靜脈注射與皮下注射兩組治療反應率相當的基礎上,從皮下給葯開始治療可使已有周圍神經病變或周圍神經病變高危患者獲益。
如果患者出現新的周圍神經病變或其癥狀加重,本品的劑量和治療方案則需要進行調整。在一項單劑量的III期試驗中隨著劑量的調整,有51%的2級及2級以上的周圍神經病變患者報告周圍神經病變有改善或消失。在一項多發性骨髓瘤的II期試驗中,因2級神經病變而退出的或有3級及3級以上周圍神經病變的患者中有73%報告周圍神經病變改善或消失。在套細胞淋巴瘤中尚未對周圍神經病變的長期轉歸進行過研究。
· 低血壓
在單葯治療多發性骨髓瘤的II期和III期試驗中,低血壓(直立性或體位性及未特殊說明的低血壓)的發生率為11%至12%。此現象在整個治療過程中均能觀察到。如果已知患者有暈厥的病史、患者服用能導致低血壓的藥物或者患者脫水,建議患者慎用本品。可以通過調整抗高血壓藥物、補液或使用鹽皮質類激素和/或擬交感神經藥物治療直立性或體位性低血壓。
· 心臟疾病
有發生急性充血性心衰或惡化,並且/或者發生左心室射血分數降低的報告,其中包括無左心室射血分數降低風險或危險係數極低患者的報告。應對存在此危險的患者或有心臟疾病的患者進行密切監測。一項單葯治療多發性骨髓瘤的III期試驗中,硼替佐米組突發心臟疾病的發生率為15%,地塞米松組為13%。兩組心力衰竭(急性肺水腫、心力衰竭、充血性心力衰竭、心源性休克、肺水腫)的發生率相似,分別為5%和4%。有發生QT間期延長的個別案例,但並未建立因果關係。
· 肝臟的不良事件
對於那些同時服用多種其它藥物的患者和有嚴重基礎疾病的患者有罕見的急性肝衰竭的報告。其它的肝臟不良事件包括肝酶升高、高膽紅素血症和肝炎。停止使用本品,上述改變可能是可逆的。對這些患者再次給葯的信息有限。
· 肺部疾病
曾有患者發生病因不明的急性瀰漫性浸潤性肺部疾病的報告,例如肺炎,間質性肺炎,肺浸潤性和急性呼吸窘迫綜合症(ARDS)。上述事件中有些是致死性的。日本對上述事件的報告比例較高。對於新出現的肺部疾病癥狀或癥狀惡化的患者,應迅速診斷並及時救治。
在一項臨床試驗中,2例複發的急性髓白血病患者在接受高劑量(2g/m)的阿糖胞苷持續輸注合併柔紅黴素和硼替佐米治療的初期發生了ARDS而死亡。
有報道不伴有左心衰或嚴重肺疾病的患者出現與本品相關的肺動脈高壓。出現新的心肺疾病或加重,應迅速進行全面診斷評價。
· 可逆性後腦白質病綜合征(RPLS)
本品治療的患者曾報告出現RPLS。RPLS是一種罕見的、可逆的神經障礙,可表現為癲癇發作、高血壓、頭痛、昏睡、意識模糊、失明以及其他視覺和神經障礙。腦成像,MRI最佳(磁共振成像)可用於證實該診斷,出現RPLS的患者應停用本品。曾有RPLS史的患者重新開始本品治療的安全性尚不清楚。
· 實驗室檢查
在使用本品治療期間應密切監測全血計數。
· 血小板減少症
本品與血小板減少有關,通常在每個療程的第11天血小板降到最低值,在下一個療程中得到恢復。血小板計數降低和恢復這種周期性模式在每周2次給葯的8個療程中保持一致,並且未觀察到累積血小板減少的現象。平均血小板計數最低值約為基線的40%。在一項單葯治療的III期試驗中,血小板減少的嚴重程度與治療前血小板計數的關係列於表5。地塞米松組和本品組明顯出血事件的發生率(≥3級)相似,分別為5%和4%。在每次給葯前應對血小板計數進行監測。當血小板計數<25,000/μL,應停止治療,劑量降低后重新開始。已有因本品引起的血小板降低造成胃腸或大腦內出血的報道,此類患者應考慮輸血。
* 血小板計數為50,000/μL是此試驗的入組合格性要求
** 1個患者的基線數據缺失
· 胃腸道不良事件
在使用本品治療可能引起噁心、腹瀉、便秘和嘔吐,有時需要使用止吐葯和止瀉藥治療。如果患者脫水,應補充體液和電解質。因為患者接受本品治療可能引起嘔吐/腹瀉,應告知患者採取適當的措施以避免脫水。應告知患者如果出現眩暈、頭暈、或虛脫應諮詢醫生。
· 腫瘤溶解綜合征
因為本品是細胞毒性藥物,並且可以快速殺死惡性細胞,可能引起腫瘤溶解綜合征的併發症。在治療前處於高腫瘤負擔的患者具有腫瘤溶解綜合征的危險。
· 肝功能損害的患者
本品通過肝酶代謝,所以本品在肝功能損害患者體內的清除可能下降。這類患者在使用本品治療時應嚴密監測其毒性。
· 對駕駛及操作機械能力的影響
本品會引起疲勞、頭暈、昏暈、或視力模糊。故出現上述癥狀的患者,不建議駕駛及操作機械。
· 請置於兒童不易拿到處。
妊娠婦女
育齡婦女在使用本品治療期間應避免受孕。
臨床前毒理學研究顯示,在器官發育期給大鼠0.075mg/kg(0.5mg/m)和家兔0.05mg/kg(0.6mg/m)注射最高試驗劑量的硼替佐米未產生畸形。上述劑量大約是臨床劑量1.3mg/m的一半(以體表面積為基礎計算)。
在器官發育期給懷孕的家兔注射0.05mg/kg(0.6mg/m),表現出明顯的流產以及胎仔成活率下降。成活的胎仔體重明顯降低。上述劑量大約是臨床劑量1.3mg/m的一半(以體表面積為基礎計算)。
尚未進行硼替佐米是否透過胎盤屏障的研究。對妊娠婦女尚未進行足夠的正規研究。如果在孕期使用本品或在治療期間受孕,孕婦應被告知本品對胎兒可能存在的危害。
在使用本品治療期間,建議患者使用有效的避孕措施,並且避免哺乳。
哺乳期婦女
尚不知硼替佐米是否通過人體乳汁分泌。鑒於許多藥物經人體乳汁分泌,以及用含有本品的乳汁餵養嬰兒可能引起潛在嚴重不良反應,應建議哺乳期婦女在接受本品治療期間不要哺乳。
18歲以下兒童用藥的安全有效性尚未確立。
在複發的多發性骨髓瘤研究的669例患者中,245(37%)例患者的年齡≥65歲:本品組125(38%)例,地塞米松組120(36%)例。本品組≥65歲患者的至疾病進展中位時間和中位緩解持續時間長於地塞米松組(至疾病進展中位時間:5.5與4.3個月,中位緩解持續時間8.0與4.9個月)。本品組年齡≥65歲可評價的患者中,40%(n=46)的患者出現了緩解(CR+PR),而地塞米松組僅為18%(n=21)。本品組≤50歲、51-64歲和≥65歲的患者中3和4級不良事件的發生率分別為64%、78%和75%。
在接受本品治療的患者中,≥65歲與年輕患者在安全性和療效上沒有總體差異;但不排除一些老年患者對本品的敏感性更高。
體外和動物離體研究顯示,硼替佐米是細胞色素P450(CYP)酶系1A2、2C9、2C19、2D6 和3A4的弱抑製劑。由於CYP 2D6對硼替佐米代謝的作用有限(7%),故可以預期慢代謝表型CYP2D6不會影響硼替佐米的整體分佈。
在一項藥物相互作用的研究中,評價了酮康唑(CYP3A4強效抑製劑)對硼替佐米的作用,12例患者的數據結果顯示硼替佐米AUC平均值增加了35%。因此,當硼替佐米與CYP3A4抑製劑(如:酮康唑、利托那韋)合用時應對患者進行密切的監測。
在一項藥物相互作用的研究中,評價了奧美拉唑(CYP2C19強效抑製劑)對硼替佐米的作用,17例患者的數據結果顯示其對硼替佐米的葯代動力學無明顯影響。
在一項藥物相互作用的研究中,評價了美法侖和潑尼松聯合療法對硼替佐米的作用,21例患者的數據結果顯示硼替佐米AUC平均值增加了17% 。此結果被認為無臨床相關性。在臨床試驗中,有糖尿病患者口服降糖葯后出現低血糖症和高血糖症的報道。在使用本品治療時,應密切監測口服抗糖尿病葯患者的血糖水平,並注意調節抗糖尿病葯的劑量。
告知患者應謹慎合用可能會引起周圍神經病變的藥物(如胺碘酮、抗病毒藥、異煙肼、呋喃妥因或他汀類)及引起血壓降低的藥物。
猴子和犬的心血管安全性藥理學研究顯示,靜脈注射的劑量(以mg/m計約為臨床推薦劑量2-3倍)與心率增加、收縮力降低、低血壓和死亡有關。心臟收縮力降低和低血壓可用正性肌力葯或升壓葯治療。給予犬致死劑量后,曾觀察到QT間期輕微增加。猴給予3.0mg/m及更高劑量(約為臨床推薦劑量的2倍),在服藥后1小時出現低血壓,進而在服藥后12-14小時死亡。
有報道用藥量高於推薦劑量2倍的患者出現癥狀性低血壓急性發作和致死性血小板減少。
尚無本品過量的特異性解救藥。一旦發生過量,應監測患者的生命指征,並採取支持療法以維持血壓(如補液、升壓葯和/或正性肌力葯)和體溫。
以下均來自國外臨床試驗。
對複發的或者難治的多發性骨髓瘤的臨床研究
為了評價本品的安全性和有效性進行了一個開放的、單臂、多中心臨床研究,共有202名受試者,他們在使用本品前至少接受了兩種治療,並且證明在最近一次治療中病情還在進展。先前治療次數的中值為6。表6對患者入組時的基本情況和疾病特徵進行了總結。
靜脈給予本品,劑量為1.3 mg/m,每周注射2次,連續注射2周后停葯10天(即21天為1個療程),最多持續8個療程。研究中考慮到毒性,對劑量進行了調整。那些對本品的治療顯效的患者允許繼續參加延續性試驗。
對本品單葯治療的療效情況列於表7中。對本品的緩解率由獨立審評委員會根據Blade等人發表的標準確定。完全緩解要求骨髓中漿細胞小於5%,M蛋白質100%減少,免疫固定檢測為陰性(IF-)。表6中同時列出了使用SWOG標準判定的緩解率。SWOG緩解要求血清骨髓瘤蛋白減少≥75%和/或尿蛋白減少≥90%。對188名患者進行了療效評價。9名患者因無法數據計量的疾病不能進行療效評價。5名患者因有極低的前期治療而被排除療效評價。
98%的受試者接受了初始劑量1.3mg/m。其中28%的受試者在整個試驗中維持此劑量,但有33%的受試者在試驗過程中降低了劑量。63%的受試者在研究過程中至少保持了一種劑量。通常,確認完全緩解后,受試者再繼續接受2個本品療程。給葯療程的平均值為6。
起效時間中值為38天(範圍30-127天)。
所有受試者存活時間中值為16個月(範圍1-18個月)。
在此研究中,對本品的緩解率與先前治療的次數和類型無關。骨髓中漿細胞大於50%或者有細胞遺傳學異常的患者存在緩解下降的可能性。試驗中觀察到本品對染色體13異常的患者有效。
對54名多發性骨髓瘤患者進行的量效關係研究中,注射本品每次1.0 mg/m或1.3 mg/m,每周注射2次,連續2周,停葯1周。兩個劑量均觀察到完全緩解,總緩解率(CR+PR)分別為30%(8/27)和38%(10/26)。
對複發的多發性骨髓瘤的隨機、開放性臨床研究
在一項國際性、前瞻性、隨機 (1:1)、分層的開放性3期臨床試驗中,比較了本品與大劑量的地塞米松對至疾病進展時間(TTP)的改善作用,本試驗納入了669例曾接受過1到3線治療的進展性多發性骨髓瘤患者。對大劑量的地塞米松不顯效的患者和基線期時外周神經病變達2級及2級以上或血小板計數<50,000/μL的患者不能參加試驗。共有627 例患者參加了療效評價。
分層因素包括先前治療的種類(1 種與1種以上)、較先前的至疾病進展的時間(最後一種治療停止后6個月內至疾病進展與接受最後一種治療6個月後複發的)和篩選的β2-微球蛋白水平 (≤2.5 mg/L 與>2.5 mg/L)。
患者的基線值和基線期的疾病特徵見表 8。
本品組的患者在接受了8個療程的 3-周治療後接受了3個療程的5-周治療。在每一個 3-周治療中,單獨靜脈給予本品 1.3 mg/m,每周注射2次,連續注射2周(即在第1、4、8和11天注射)后停葯10天(即從第12至第21天)。在5-周治療中,單獨靜脈給予本品 1.3 mg/m,每周注射1次,連續注射4周(即在第1、8、15和22天注射)后停葯13天(即從第23至第35天)。
地塞米松組患者在接受了4個療程的 5-周治療後接受了5個療程的4-周治療。在5-周的治療中,第1天至第4天、第9天至第12天和第17天至第20天口服地塞米松40 mg/天,之後停葯15天(即從第21至第35天)。在4-周的治療中,第1天至第4天口服地塞米松40 mg/天,之後停葯24天(即從第5至第28天)。將口服地塞米松有進展性疾病的患者納入相關的其他試驗中按照標準劑量和方法給予本品治療。
按計劃對至疾病進展事件時間進行了中期分析之後,地塞米松組停止給葯。不論病情如何,所有隨機分入地塞米松組的患者都改為接受本品治療。在試驗停止時進行最終的統計分析。由於試驗結束較早,所以生存患者(n=534)的隨訪中位數定為8.3個月。
本品組全部8個療程3-周治療期間,34%的患者接受了至少1個劑量的本品,在全部11個療程中有13%的患者接受了至少1個劑量的本品。此試驗中本品的給葯次數的均值是22,範圍是 1至 44。地塞米松4個療程的 5-周治療期間, 40%的患者接受了至少1個劑量的地塞米松,在全部9個療程中有6%的患者接受了至少1個劑量的地塞米松。
上述3期臨床試驗的事件發生時間分析和緩解率見表9。應用歐洲骨髓移植協作組(EBMT)的標準來評價緩解和進展。1完全緩解(CR):要求骨髓中漿細胞小於5%,血清M-蛋白減少100%,免疫固定檢測為陰性(IF-)。部分緩解(PR):要求最少每6周檢測不少於兩次,血清M-蛋白減少≥50%和/或尿M-蛋白減少≥90%;鈣正常和骨疾病穩定。接近完全緩解(nCR)定義為達到所有完全緩解的標準包括蛋白電泳結果M-蛋白減少100%,但在免疫固定檢測中仍可測到M-蛋白(IF+)。
a Kaplan-Meier 評估。
b 危險比是將環氧化酶比例-風險模型作為單個獨立變數而得到的。危險比小於1說明本品有優勢。
c p值由包括隨機分層因素在內的分層log-rank檢驗得到。
d 不能得到精確的p值。
e 緩解評價的病例數,包括在基線期疾病可評價且接受過至少一次本試驗治療的患者。
f EBMT 標準;nCR 符合所有EBMT的CR標準,但IF檢測陽性。在EBMT 標準中,nCR包括在 PR 內。
g 在2例患者中,IF結果未知。
h 緩解率(CR+PR)的 p值是由分層因素校正後的 Cochran-Mantel-Haenszel卡方檢驗得到的。
i 未評估。
j 不適用,此分類中無患者。
對複發的套細胞淋巴瘤的II期單臂臨床研究
在一項開放性、單臂、多中心試驗中評價了本品用於治療複發的或難治的套細胞淋巴瘤患者的安全性和有效性,本試驗納入的155例患者都曾至少接受過一次治療且疾病進展。患者的年齡中位數為65歲(42-89歲),其中81%為男性,92%為白人。75%的患者有一處或多處結節外病灶,77%的患者處於套細胞淋巴瘤IV期。91%的患者採用的先前治療是一種蒽環類抗生素或米托蒽醌、環磷醯胺和利妥昔單抗。37%的患者對先前的最後一個治療耐葯。本品的推薦劑量是1.3mg/m,每周2次,連續2周(在第1,4,8和11天給葯,之後休息10天)。所有接受本品治療的患者的中位治療周期數是4(範圍:1-17),對本品顯效的患者接受的周期中位數是8.試驗中本品治療后的緩解率見表10。依據國際研討會緩解標準(International Workshop Response Criteria,IWRC)、基於對CT掃描的獨立放射學評價確定本品治療后的緩解率。
對生存患者的隨訪中位數是13個月,生存中位數尚未得到,1-年生存率的Kaplan Meier評估是69%,出現緩解的患者中1-年生存率的Kaplan Meier評估是94%,達到CR或CRu的患者中1-年生存率的Kaplan Meier評估是100%。
藥理作用
硼替佐米是哺乳動物細胞中26S蛋白酶體糜蛋白酶樣活性的可逆抑製劑。26S蛋白酶體是一種大的蛋白質複合體,可降解被泛素化的蛋白質。泛素蛋白酶體通道在調節特異蛋白在細胞內的濃度中起到重要作用,以維持細胞內環境的穩定。蛋白水解會影響細胞內多級信號串聯,這種對正常細胞內環境的破壞會導致細胞的死亡。而對26S蛋白酶體的抑制可防止特異蛋白的水解。體外試驗證明硼替佐米對多種類型的癌細胞具有細胞毒性。臨床前腫瘤模型體內試驗證明硼替佐米能夠延遲包括多發性骨髓瘤在內的腫瘤生長。
體外實驗、離體試驗及動物模型 數據表明,本品能夠促進骨細胞分化和增加其活性,且抑制破骨細胞的功能。上述作用可以在使用本品治療的罹患晚期溶骨性病變的多發性骨髓瘤患者中觀察到。
每周兩次給予1mg/m和1.3mg/m劑量的硼替佐米后(每劑量水平n=12),對於全血中20S蛋白酶體活性的最大抑制(相當於基線)出現在給葯后5分鐘。1和1.3mg/m劑量對20S蛋白酶體有著大體相同的最大抑制。1mg/m和1.3mg/m給藥劑量的最大抑制範圍分別是70%-84%和73%-83%。
毒理研究
採用類似於患者推薦給藥劑量和給葯頻率進行動物試驗(即兩周內每周兩次給葯,隨後休息一周),觀察到的毒性包括重度貧血和血小板減少症及胃腸道、神經和淋巴組織樣系統毒性。動物試驗中硼替佐米的神經毒性包括軸突腫脹和周圍神經、脊髓神經根以及脊髓束的退行性變化。此外,大腦、眼睛和心臟中出現了多灶性出血和壞死。
心血管毒性:
猴給予約2倍於推薦臨床劑量的硼替佐米可造成心率升高,隨後伴以嚴重的進行性低血壓、心率過緩並在給葯后12到14小時死亡。大於等於1.2mg/m的劑量可誘導各心臟參數出現與劑量成正比的變化。研究顯示硼替佐米可分佈於體內大部分組織中,其中包括了心肌。在猴重複給葯毒性試驗觀察到了心肌出血、炎症和壞死。
遺傳毒性:
中國倉鼠輪炒細胞體外染色體畸變試驗顯示硼替佐米具有誘裂變活性(染色體結構畸變)。Ames試驗和小鼠體內微核試驗結果未顯示硼替佐米有遺傳毒性。
生殖毒性:
尚未對生育影響進行研究,但在毒性試驗中對生殖組織進行了評價。6個月的大鼠毒理試驗顯示,劑量≥0.3mg/m(臨床推薦劑量的1/4)的硼替佐米可使卵巢發生退化,劑量為1.2mg/m時可觀察到卵巢有退化性改變。本品可能對男性或女性的生育能力有潛在影響。
致癌性:
尚未進行硼替佐米的致癌性研究。
24例多發性骨髓瘤患者靜脈給予本品1.0mg/m和1.3mg/m(每個劑量12例)后,首劑量(第1天)的最大血葯濃度均值分別是57和112ng/mL。在隨後的每周2次的給葯過程中,本品的最大血葯濃度均值的範圍是67至106ng/mL(1.0mg/m劑量組)和89至120ng/mL(1.3mg/m劑量組)。多次給葯后的硼替佐米的平均消除半衰期是40-193小時(1mg/m劑量組)和76至108小時(1.3mg/m劑量組)。1.0mg/m和1.3mg/m組首次給葯后的總體清除率均值分別為102和112L/h,而1.0mg/m和1.3mg/m組隨後劑量的總體清除率均值在15-32L/h之間。
在Ⅲ期試驗的PK/PD研究中,多發性骨髓瘤患者在接受一次1.3mg/m劑量的靜脈給葯或皮下給葯(靜注組n=14,皮下組n=17)后,兩組重複給葯后的全身暴露總量(AUClast)相等。皮下給葯后的Cmax(20.4ng/mL)低於靜注(223ng/mL)給葯。AUClast幾何均值之比為0.99,90%置信區間為80.18%-122.80%。
分佈
多發性骨髓瘤患者給予單劑量或多劑量1.0mg/m和1.3mg/m硼替佐米后,患者體內的分佈容積均值的範圍是489-1884L/m,這說明硼替佐米可廣泛分佈於外周組織。濃度為100-1000ng/mL 時,硼替佐米與人體血漿蛋白的平均結合率為83%。
代謝
利用人體肝微粒體和互補脫氧核糖核酸(cDNA)表達的細胞色素P450同工酶進行的體外研究顯示,硼替佐米主要通過細胞色素P450酶系的3A4、2C19和1A2酶氧化代謝,少量經2D6和2C9代謝。主要代謝途徑是去硼酸化,形成2個去硼酸化代謝物,再通過羥基化形成幾個代謝產物。去硼酸化的硼替佐米代謝產物無抑制26S蛋白酶體的活性。8名患者給葯后10-30分鐘的血漿數據顯示,血漿中代謝產物的濃度比原形藥物低。
消除
尚未對硼替佐米在人體內的消除途徑進行研究。
年齡
對39例接受1.0mg/m和1.3mg/m硼替佐米靜脈注射的多發性骨髓瘤患者第1個療程的首劑量(第1天)數據的分析表明,年輕患者體內經劑量校正的AUC和Cmax更低。<65歲患者(n=26)體內經劑量校正後的AUC和Cmax低於≥65歲患者約25%(n=13)。
性別
第1個療程的首劑量(劑量為1和1.3mg/m)后,男性(n=22)與女性(n=17)患者的劑量校正AUC和Cmax均值具有可比性。
人種
因大部分患者為白種人,故無法評價人種對硼替佐米暴露量的影響。
肝功能損害的患者
評價了51例癌症患者伴肝功能損害對本品葯代動力學的影響,試驗中本品劑量範圍從0.5到1.3mg/m。與肝功能正常的患者相比,輕度肝功能損害不會改變劑量標準化AUC。但在中度或重度肝功能損害的患者中劑量標準化AUC的均值會增加約60%。建議中度或重度肝功能損害的患者使用本品時降低起始劑量,同時應進行嚴密的監測。
腎功能損害的患者
在一項葯代動力學研究中,不同程度的腎功能損害患者按肌肝清除率(CrCL)分組:正常 (CrCL≥60 mL/分鐘/1.73 m,n=12),輕度 (CrCL=40-59 mL/分鐘/1.73 m,n=10),中度 (CrCL=20-39 mL/分鐘/1.73 m,n=9)和重度 (CrCL<20 mL/分鐘/1.73 m,n=3)。本研究包括需透析且在透析結束后再給予本品的患者8例。 本品靜脈的劑量為0.7~1.3 mg/m,每周2次。本品的暴露量(劑量校正後的AUC 和 Cmax) 在各組中有可比性。
兒童
尚無兒科患者的葯代動力學數據。
避光,不超過30℃保存。
玻璃藥瓶包裝;1瓶/盒。