環辛四烯
環辛四烯
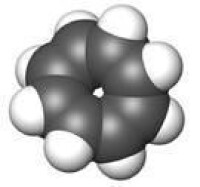
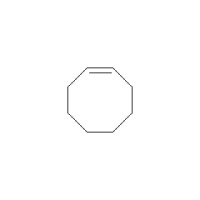
環辛四烯(COT)全稱“1,3,5,7-環辛四烯”,是環辛烷的完全不飽和衍生物,化學式C8H8。室溫下為無色至金黃色液體。屬於環狀多烯烴,結構與苯相似。與苯不同的是,環辛四烯不具芳香性。它的化學性質類似於不飽和烴,可以發生加成反應,易加氫生成環辛烷,也容易被氧化和發生聚合。相反苯則易進行親電取代反應。
環辛四烯
英文同義詞:[8]Annulene;COT;CYCLOOCTATETRAENE;CYCLOOCTATETRAENE(1,3,5,7-);1,3,5,7-CYCLOOCTATETRAENE;1,3,5,7-COT;cyclooctatetraene stab.;CyclooctatetraeneCOTpaleyellowliq
分子量:104.15
EINECS號:211-080-3
Mol文件:629-20-9.mol
環辛四烯
英文名 Cyclooctatetraene
IUPAC英文名 1,3,5,7-Cyclooctatetraene
別名 1,3,5,7-環辛四烯
-輪烯
縮寫 COT
識別
CAS號 629-20-9
RTECS號 CY1400000
SMILES C1=C/C=C\C=C/C=C\1
化學式 CH
摩爾質量 104.15 g mol−1
外觀 金黃色液體
密度 0.9250 g/cm3; (液體)
熔點 −5 -−3°C (268-270K)
沸點 142-143°C (415-416K)
閃點22.22℃(-)
自然溫度 561 °C
在水中的溶解度 不互溶
環辛四烯
EU分類 可燃(F)
第一類致癌物質
第二類致誘變劑
有毒(T)
NFPA 704
環辛四烯
3
警示性質 R45, R46, R11, R36/38,
標準詞 R48/23/24/25, R65
安全建議 S53, S45
標準詞
相關化學品
相關化學品環丁二烯、苯、環辛烷
若非註明,所有數據都依從國際單位制,以及來自標準狀況(25 °C, 100 kPa)的條件。
環辛四烯穩定性不高,容易生成爆炸性的有機過氧化物,因此市售產品中通常加入少量的氫醌作穩定劑。使用環辛四烯之前應當檢驗過氧化物的存在。過氧化物多以白色晶體的形式附著在瓶蓋和瓶頸周圍,如果處理方式不當可能引發爆炸,因此使用時必須小心。環辛四烯的化學性質類似於多烯烴:它可以與過酸或二甲基過氧化酮作用生成單或多環氧化的產物,也可以與溴、鹵化氫發生加成反應。烷基取代的環辛四烯發生開環複分解聚合,可以得到穩定的聚乙炔衍生物。環辛四烯可以發生電環化反應生成雙環[4.2.0]辛-2,4,7-三烯,這兩者形成平衡但以環辛四烯為主(99.99%),雙環形式只佔約0.01%。但環辛四烯溴化時,主要生成的是7,8-二溴雙環[4.2.0]辛-2,4-二烯。(參考資料)在70℃和~300nm光源照射氣相環辛四烯時,環辛四烯可以幾乎定量地異構為半瞬烯(Semibullvalene)——三環[3.3.0.0 ]辛-3,6-二烯。
衍生出的負離子:
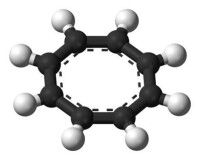
環辛四烯雙負離子COT2−的球棍模型結構。
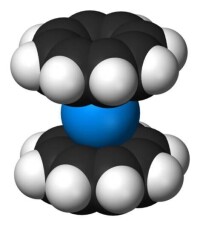
雙(環辛四烯基)鈾
雙(環辛四烯基)鈾是環辛四烯配合物的一個例子,它屬於夾心型配合物,兩個環辛四烯環分別位於鈾原子上下。
環辛四烯(COT)與金屬鉀作用時生成KCOT,其中環辛四烯被還原為深棕色10π有芳香性、平面結構的COT 雙負離子。以KCOT為原料,可以製得一些環辛四烯可以與金屬(如稀土金屬)形成的配合物,比如夾心型的雙(環辛四烯基)鈾U(COT)、雙(環辛四烯基)鐵Fe(COT),以及一維結構的Eu-COT。
Fe(COT)在甲苯中與二甲基亞碸和二甲氧基乙烷迴流5天後,轉化為四氧化三鐵(磁鐵礦)和含有碳納米管的晶狀碳單質。
結構:
雖然早期的電子衍射實驗結果顯示環辛四烯中的碳-碳鍵長是等同的,但一開始對環辛四烯的研究便顯示出,環辛四烯沒有表現出預期的芳香性。後來H.S. Kaufman的X光衍射結果也證實了環辛四烯中的碳-碳鍵確有兩種不同的鍵長,C=C鍵鍵長為1.34Å,C-C鍵鍵長為1.48Å。這說明,環辛四烯雖然與苯一樣是一種輪烯,但它不是芳香烴,通常狀態下為非平面的澡盆型結構(D2d),鍵角∠C=C-C = 126.1°,∠C=C-H = 117.6°。由於不是平面結構,因此環辛四烯既沒有芳香性,也沒有反芳香性,也不適用於休克爾規則分析。如果將環辛四烯浴盆狀構象(D2d)的能量看作0,那麼理論計算得出其雙鍵定域的平面結構(D4d)的能量為44.35kJ/mol,其雙鍵電子離域的平面結構(D8d)的能量則為61.50kJ/mol(HF/6-31G*結果)。因此環辛四烯最穩定的構象是澡盆型。由於不為平面結構且雙鍵定域,因此取代的環辛四烯可能有兩種異構體:環反轉(類似於胺的氮反轉)異構體,以及雙鍵易位的互變異構體(類似於苯的兩種凱庫勒式)。
天然存在形式:
環辛四烯已在某些真菌中分離出來。
環辛四烯沒有苯系化合物的特性,是典型的不飽和烴。能與溴、氫鹵酸等起加成反應,也能催化加氫生成環辛烷,易被氧化,並易聚合,用於製造合成纖維、染料、藥物等。
1,3,5,7-環辛四烯最初在1905年由里夏德·維爾施泰特(Richard Martin Willst tter)在慕尼黑合成。上述合成中的原料偽石榴鹼分子中已經有一個八元環。在經過十三步反應之後,反應的總產率很低只有0.75%,最後分離出的產物也只有1g左右。因此環辛四烯在當時是相當難得到的物質,對它性質的研究也很不充分。上述合成方法當時被認為是有機合成中新穎的合成法之一,但受其複雜性所限,它僅被其他化學家重複過一次,這使維爾施泰特感到十分苦惱。以上合成法中,第一個箭頭為鈉/醇還原酮為醇,以及酸性條件下消除水,第二個箭頭為胺的甲基化和季銨鹽的霍夫曼消除反應,第三個箭頭同樣為胺甲基化和霍夫曼消除,第四個箭頭為溴對多烯的共軛加成和二甲胺的親核取代,最後一個箭頭再次為胺甲基化和霍夫曼消除反應。多次對霍夫曼消除反應的利用可能是維爾施泰特能成功合成反應性很強的環辛四烯的秘訣。1939年至1943年間,美國的化學家製取環辛四烯均未成功,因此這些人對維爾施泰特的合成產生了質疑,稱維爾施泰特並未制出環辛四烯,而是制出了它的同分異構體苯乙烯。維爾施泰特在他的自傳中回答說,他將環辛四烯催化氫化還原后得到了環辛烷,將環辛四烯氧化后也得到了辛二酸,從而證明了他制出的不是苯乙烯。1947年,查爾斯·奧弗貝格(CharlesOverberger)在亞瑟·科雷·科普(Arthur Cope)的指導下,終於通過重複維爾施泰特的試驗,成功制出了環辛四烯。
1940年德國化學家沃爾特·列培(Walter Reppe)在研究乙炔的化學性質時,偶然發現了另一條製取環辛四烯的路線,即乙炔四聚法。他將乙炔在四氫呋喃(THF)中的溶液、碳化鈣和一種鎳鹽催化劑在20個大氣壓下供熱,得到了產率非常高(90%)的環辛四烯。其中使用的鎳鹽通式為NiX,可以是氰化鎳、乙醯乙酸鎳或硫氰酸鎳。反應過渡態中鎳原子以八面體分別與兩個X(鄰位)與四個乙炔配位,四個乙炔的特定排列方式有利於四聚合進行,使這一在熵變上不利的環化反應變為可能,而且可以以頗高的收率生成四聚產物。在1948年列培將這個發現發表后,乙炔四聚法成了製取環辛四烯的最主要方法,用這個方法可以實現環辛四烯的大量生產。
