免疫沉澱
免疫沉澱
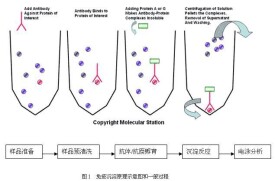
免疫沉澱是利用抗體特異性反應純化富集目的蛋白的一種方法。抗體與細胞裂解液或表達上清中相應的蛋白結合后,再與蛋白A/G(ProteinA/G)或二抗偶聯的agarose或Sepharose珠子孵育,通過離心得到珠子-蛋白A/G或二抗-抗體-目的蛋白複合物,沉澱經過洗滌后,重懸於電泳上樣緩衝液,煮沸5-10min,在高溫及還原劑的作用下,抗原與抗體解離,離心收集上清,上清中包括抗體、目的蛋白和少量的雜蛋白。
免疫沉澱的成功依賴於抗原的純度以及製備抗體的難易,主要受兩方面因素的影響:1、抗原原液的丰度,2、抗體對抗原的親和力。
有3種類型的抗體可用於免疫沉澱:多克隆抗體,混合單克隆抗體和單克隆抗體。
| 多克隆抗體 | 混合單克隆抗體 | 單克隆抗體 |
| 反應強度極好 | 抗體依賴性(極差到極好)極好 | |
| 特異性一般良好(有時本底高) | 極好,但有些出現交叉反應 | 極好,避免使用有交叉反應的抗體 |
| 優點穩定,多價反應特異 | 供應不受限制穩定,多價反應特異 | 供應不受限制 |
| 缺點本底不易清除 | 需對抗原有高親和力 | 供應不普遍 |
多抗的本底較高,可通過滴定產生免疫沉澱所需的抗血清量,來有效地清除某些非特異性本底。其方法是將特異性抗體降低到能定量結合抗原的最低滴度,使本底保持最低。
免疫沉澱要求抗原的純度儘可能提高。降低本底,用不與待檢抗原結合的非特異性抗體預處理,可以從抗原溶液中除去非特異性結合蛋白,即此法第一次是用非免疫抗體降低本底,第二次再用所研究的抗體,這樣進行二次免疫沉澱是達到純化免疫沉澱物最有效的方法。
免疫沉澱
(2)取少量裂解液以備Western blot分析,剩餘裂解液將1μg相應的抗體和10-50 μl protein A/G-beads加入到細胞裂解液,4°C緩慢搖晃孵育過夜;
(3)免疫沉澱反應后,在4°C 以3,000 g速度離心5 min,將protein A/G-beads離心至管底;將上清小心吸去,protein A/G-beads用1ml裂解緩衝液洗3-4次;最後加入15μl的2×SDS 加樣緩衝液,沸水煮10分鐘;
(4)SDS-PAGE, Western blotting或進行質譜分析。
免疫沉澱的實驗過程比較簡單,一般分為3個階段;①抗原溶液的製備;②裂解物非特異性本底的預處理;③免疫複合物的形成與純化。免疫沉澱的第一步是製備抗原溶液。任何抗原溶液均可作為免疫沉澱的材料來源,但免疫沉澱一般採用細胞或組織製備的裂解物。裂解物的製備可採用多種方法,其中首選用溫和的去污劑如非離子去污劑來裂解細胞。該方法能溶解細胞膜,破壞蛋白質之間許多微弱的相互作用,釋放出大多數細胞內抗原。更重要的是方法十分溫和,不破壞大多數抗原的結構和酶的活力。如果對抗原結構的完整或活力要求不嚴,或者抗原結合較為緊密,可以採用比較劇烈的條件來製備裂解物,如在強變性劑的溶液中進行煮沸,然後在免疫沉澱前經過稀釋去除變性劑。一旦細胞裂解液製備好,即可進行預處理。
免疫沉澱一般用於分析抗原的生化特性,因此要求抗原的純度儘可能高。抗原和抗體的相互作用與其各自的內在性質有關,故提高該技術信—噪比最容易的方法是降低本底。
經過預處理后,在裂解物中加入特異性抗體,由於抗體對其相應抗原的高度親和力,因此容易快速形成免疫複合物。然後,將免疫複合物經蛋白A或蛋白G結合的瓊脂糖或聚丙烯醯胺微珠等固相基質進行純化。蛋白A和蛋白G對抗體的Fc段有較高的親和力。蛋白A/G與抗體結合后,通過洗滌微珠即可除去未結合的蛋白,剩下與基質結合的即是純化的抗原抗體複合物。