半數致死量
半數致死量(LD50)
半數致死量(median lethal dose, LD50)表示在規定時間內,通過指定感染途徑,使一定體重或年齡的某種動物半數死亡所需最小細菌數或毒素量。在毒理學中,半數致死量,簡稱LD50(即Lethal Dose, 50%),是描述有毒物質或輻射的毒性的常用指標。按照醫學主題詞表(MeSH)的定義,LD50是指“能殺死一半試驗總體之有害物質、有毒物質或遊離輻射的劑量”。這測試最先由J.W. Trevan於1927年發明。
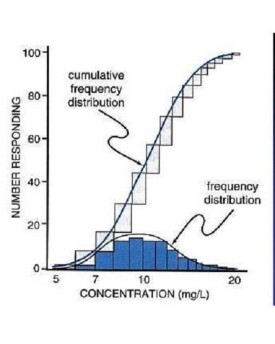
半數致死濃度(LC50),即能使一群動物在接觸外源化學物一定時間(一般固定為2~4小時)后並在一定觀察期限內(一般為14小時)死亡50%所需的濃度。一般以mg/m³表示空氣中的外源化學物濃度,以mg/L表示水中的外源化學物濃度。
在測定某種毒物的半致死濃度(semilethal concentration,LC50)時,經常用到四個指標,分別是24小時半數致死濃度24h LC50;48小時半數致死濃度48h LC50;72小時半數致死濃度72h LC50;96小時半數致死濃度96h LC50。
在環境毒理學中,還常用半數耐受限量(mediantolerancelimit,TLm),也稱半數存活濃度來表示一種環境污染物對某種水生生物的急性毒性。TLm是指在一定時間內一群水生生物中50%個體能夠耐受的某種環境污染物在水種的濃度,單位mg/L。
乙醇對年輕和年老大鼠的口服LD50分別為10.6 g/kg和7.06 g/kg。
煙鹼(尼古丁)對大鼠的口服LD50為50 mg/kg。
LD50的表達方式通常為有毒物質的質量和試驗生物體重之比,例如"毫克/千克體重"。雖然毒性不一定和體重成正比,但這種表達方式仍有助比較不同物質的相對毒性,以及估計同一物質在不同大小動物之間的毒性劑量。
應用半數致死這量度方法有助減少量度極端情況所帶來的問題,以及減少所需試驗次數;然而這亦代表LD50並對所有試驗生物的致死量:有些可能死於遠低於LD50的劑量,有些卻能在遠高於LD50的劑量下生存。在特殊需要下,研究人員亦可能會量度LD1或LD99等指標(即殺死1%或99%試驗總體之劑量)。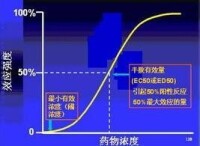

半數致死量
物質的毒性往往受給予方式影響。一般而言,口服毒性會低於靜脈注射的毒性。故此在表達LD50時經常會附帶給予方式,例如“LD50 i.v.”表示靜脈注射下的LD50。
和LD50相關的兩種指標,LD50/30和LD50/60,是分別指在沒有治療的情況下,導致受試總體在30天或60天後半數死亡的劑量。這些指標通常用於描述輻射毒性。
另一種毒性指標,LCt50,包含了濃度(C)和暴露時間(t)的描述,通常以"毫克·分鐘/立方米"作描述,類似的ICt50則是使半數人員失能的劑量。這兩種指標通常作描述化學武器,其毒性亦受呼吸速度和衣著影響。Ct這概念最先由弗里茨·哈伯提出,假設在100 mg/m3下暴露1分鐘和10 mg/m3下暴露10分鐘是相等的。然而這定律對於一些可以被身體快速分解的物質如氰化氫便不適用;在這種情況下,需要一定的暴露時間才可確定致死量。在環境研究中,LCt亦可用於描述水中的有毒物質。
對於病原體,亦有一種類似的半數感染量(ID50)的概念,是指在某一給予途徑下足以令半數受試群體感染的病原體數量,例如口服1200個病原體/人。因為病原體數量難以量度,感染量亦會以對不同動物的LD50表達。對於生物武器的感染量,亦可以ICt50表達。
例子
乙醇對年輕和年老大鼠的口服LD50分別為10.6 g/kg和7.06 g/kg。
菸鹼(尼古丁)對大鼠的口服LD50為50 mg/kg。
動物權利組織一直批評以動物進行LD50測試,特別是一些物質可能令動物在長時間痛苦下死去。一些國家如英國已開始禁止口服LD50測試,而經濟合作與發展組織(OECD)亦在2001年廢除對口服毒性測試的要求。
Reed-Muench法
生物受到病毒感染后,體內產生特異性中和抗體,並與相應的病毒粒子呈現特異性結合,因而阻止病毒對敏感細胞的吸附,或抑制其侵入,使病毒失去感染能力。中和試驗(Neutralization Test)是以測定病毒的感染力為基礎,以比較病毒受免疫血清中和后的殘存感染力為依據,來判定免疫血清中和病毒的能力。
中和試驗常用的有兩種方法:一種是固定病毒量與等量系列倍比稀釋的血清混合,另一種是固定血清用量與等量系列對數稀釋(即十倍遞次稀釋)的病毒混合;然後把血清-病毒混合物置適當的條件下感作一定時間后,接種于敏感細胞、雞胚或動物,測定血清阻止病毒感染宿主的能力及其效價。如果接種血清病毒混合物的宿主與對照(指僅接種病毒的宿主)一樣地出現病變或死亡,說明血清中沒有相應的中和抗體。中和反應不僅能定性而且能定量,故中和試驗可應用於:
● ● 病毒株的種型鑒定:中和試驗具有較高的特異性,利用同一病毒的不同型的毒株或不同型標準血清,即可測知相應血清或病毒的型,所以,中和試驗不但可以定屬而且可以定型。
● ● 測定血清抗體效價:中和抗體出現於病毒感染的較早期,在體內的維持時間較長。動物體內中和抗體水平的高低,可顯示動物抵抗病毒的能力。
● ● 分析病毒的抗原性。
毒素和抗毒素亦可進行中和試驗,其方法與病毒中和試驗基本相同。
用組織細胞進行中和試驗,有常量法和微量法兩種,因微量法簡便,結果易於判定,適於作大批量試驗,所以得到了廣泛的應用。
固定血清
-稀釋病毒法(病毒中和試驗)
● ● 病毒毒價的測定 毒價單位:衡量病毒毒價(毒力)的單位過去多用最小致死量(MLD),即經規定的途徑,以不同的劑量接種試驗動物,在一定時間內能致全組試驗動物死亡的最小劑量。但由於劑量的遞增與死亡率遞增不呈線性關係,在越接近100%死亡時,對劑量的遞增越不敏感。而一般在死亡率越接近50%時,對劑量的變化越敏感,故現多改用半數致死量(LD50)作為毒價測定單位,即經規定的途徑,以不同的劑量接種試驗動物,在一定時間內能致半數試驗動物死亡的劑量。用雞胚測定時,毒價單位為雞胚半數致死量(ELD50)或雞胚半數感染量(EID50)。用細胞培養測定時,用組織細胞半數感染量(TCID50)。在測定疫苗的免疫性能時,則用半數免疫量(IMD50)或半數保護量(PD50)。
固定病毒
稀釋血清法(血清中和試驗)
● ● 病毒毒價的測定(微量法)
● ● (1) 病毒的製備 將病毒接種於單層細胞,37℃吸附1h后加入維持液,置溫箱培養;逐日觀察,待細胞病變(CPE)達75%以上,收穫病毒懸液凍融或超聲波處理,以3 000r/min離心10min,取上清液,定量分裝成1ml小瓶置-70℃保存備用,選用的病毒必須是對細胞有較穩定的致病力。
● ● (2) 病毒毒價測定 取置-70℃冰箱保存的病毒一瓶,將病毒在96孔培養板上作10倍遞進稀釋即10,10,10……,每孔病毒懸液量為50μl,每個稀釋度作8孔,每孔加入100細胞懸液,每塊板的最後一行設8孔細胞對照,製備細胞懸液的濃度以使細胞在24h內長滿單層為度。把培養板置5%CO2溫箱37℃培養,從48-14h逐日觀察細胞病變,記錄結果。