紅氧
紅氧
形成於正常大氣壓的54.36K(-218.79°C)以下。固態的氧氣由於吸收紅色光,像液氧一樣,是淺藍色透明物質。氧分子因它在分子磁化(molecular magnetization)上與晶體結構、電子排布、超導電性的關係而受到關注。氧分子是能承載磁矩的唯一的簡單雙原子分子(通常情況下縱使所有分子也只有少數能夠如此)。它被認為是“受自旋控制(spin-controlled)”的晶體,並因此展現出不尋常的磁性規律。在極高壓下,固氧從熱絕緣材料變成金屬的形態;而在極低溫下,它甚至能變成超導體。對固氧的結構研究始於19世紀20年代,如今,已確定六種涇渭分明的晶體相。
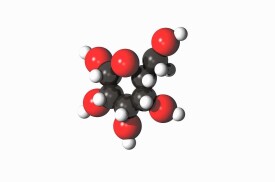
隨著室溫下氧氣的壓強超過10GPa,它將出人意料地相變為另一個同素異形體。它的體積驟減,顏色也從藍變成深紅。這種ε相發現於1979年,但當時它的結構並不清楚。基於它的紅外線吸收光譜,1999年,研究人員推斷此相態是O分子的晶體。但在2006年,X射線晶體學表明這個被稱作ε氧或紅氧的穩定相態實為O。此結構在理論上不曾被預測:由四個氧分子O組成的菱形的O原子簇。

ε氧的晶體結構的一部分
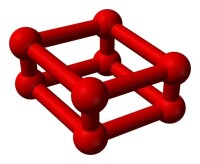
O8分子球棍結構
所有相態中,這個相態相當有趣。它顏色為深紅色,對紅外線吸收能力很強,並有磁場縮滅(magnetic collapse)。它在很大的壓強範圍內(10GPa至96GPa)穩定,已成為許多X射線衍射、光譜學和理論學者的課題。
它表現出單斜晶系中的C2/m對稱
它對紅外線的吸收被認為是氧分子的聯合的堆砌的結果。
液氧已被用作火箭中的氧化劑,紅氧則被認為可能會是更好的氧化劑,因為它能量密度更高。
研究人員認為這種結構可能極大地影響對元素結構的研究。
600K以上的溫度下,17GPa的壓強亦能生成此相態。
氣壓為11GPa時,O原子簇內的鍵長為0.234納米,原子簇之間距離為0.266納米。而氧分子O的鍵長是0.120納米。
研究中O原子簇的構成原理尚不清楚,研究人員認為氧分子間電荷的運動或者磁矩在這種構成中起重要作 用。
O 遭遇96GPa以上的高壓就會變為金屬氧,不僅會導電,在低溫下表現出超導性