冰鹽
冰鹽
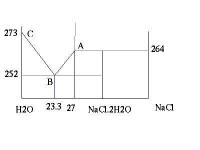
常見的冰鹽是冰和氯化鈉溶液的混合物。如圖是NaCl-H2O 體系的相圖(示意圖),橫坐標NaCl含量,縱坐標溫度
A點向上的線是NaCl的飽和線,一般是向右偏的,NaCl在水中溶解度隨溫度變化不大,這裡畫出一條近似豎直的線
冰鹽
給飽和NaCl降溫,在264K(-9C)析出晶體NaCl.2H2O,252K(-21C)全部變為冰和晶體NaCl.2H2O。
當給NaCl的含量23.3%的溶液降溫,在252K以上都會保持液態,以下變為冰和晶體NaCl.2H2O。
AB,BC兩條線是向上彎曲的,這裡只是示意圖,沒找到數據,粗略的計算可認為是直線。
如果是給冰鹽混合物升溫,分析方法相同,主要是看兩條水平線(溫度)。
冰和NaCl混合併不能自動降低溫度,只是降低了凝固點。
冰鹽混合物是一種有效的驅寒劑。當鹽摻在碎冰里,鹽就會在冰中溶解而發生吸熱作用,使冰的溫度降低。冰鹽混合在一起,在同一時間內會發生兩種作用:一種是會大大加快冰的溶化速度,而冰溶化時又要吸收大量的熱;另一種是鹽的溶解也要吸收溶解熱。因此,在短時間內能吸收大量的熱,從而使冰鹽混合物溫度迅速下降,它比單純冰的溫度要低得多。
冰鹽混合物的溫度高低,是依據冰中摻入鹽的百分數而決定的,如用鹽量為冰的 23.3%時,最低溫度可達-21℃。
常在化學實驗中用來冷卻或者凝固產生的低沸點物質。這一過程叫做冰鹽浴。
冰鹽浴的降溫原理與溶液的凝固點下降有關。當食鹽和冰均勻地混合在一起時,冰因吸收環境熱量稍有融化 變成水,食鹽遇水而溶解,使表面水形成了濃鹽溶液。由於濃鹽溶液的冰點較純水低,而此時體系中為濃鹽溶液和冰共存,因此體系的溫度必須下降才能維持這一共 存狀態(濃鹽溶液和冰的共存溫度應該比純水的冰點更低)。這將導致更多的冰融化變成水來稀釋濃鹽溶液,在融化過程中因大量吸熱而使體系溫度降低。
低溫冰鹽浴配方:(碎冰用量100克)
浴溫(℃) 鹽類及用量(克) 浴溫(℃) 鹽類及用量(克)
-4.0 CaCl2·6H2O(20g) -30.0 NH4Cl(20g)+NaCl(40g)
-9.0 CaCl2·6H2O(41g) -30.6 NH4NO3(32g)+ NH4CNS(59g)
-21.5 CaCl2·6H2O(81g) -30.2 NH4Cl(13g)+ NaNO3(37.5g)
-40.3 CaCl2·6H2O(124g) -34.1 KNO3(2g)+ KCNS(112g)
-54.9 CaCl2·6H2O(143g) -37.4 NH4CNS(39.5g)+NaNO3(54.4g)
-21.3 NaCl(33g)
-17.7 NaNO3(50g) -40 NH4NO3(42g)+NaCl(42g)
在生活中一般不用冰鹽,但是要用到這種降低凝固點的方法。比如公路除雪除冰常用氯化鈣或者氯化鈉灑在冰雪區,即可迅速融化。其實不是升高了溫度,而是降低了水溶液的凝固點。比如,當氣溫-10度時,路面水結冰了,但是如果撒上氯化鈣CaCl2,然後就會和一部分冰結合,而產生的溶液即使在-20度仍然是液態,這就能較長時間保證水不凝固,達到路面防滑的目的。
