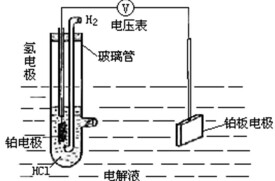
標準氫電極
零電位的標準
由於單個電極的電勢無法確定,故規定任何溫度下標準狀態的氫電極的電勢為零,任何電極的電勢就是該電極與標準氫電極所組成的電池的電勢,這樣就得到了“氫標”的電極勢。標準狀態是指氫電極的電解液中的氫離子活度為1,氫氣的壓強為0.1兆帕(約1大氣壓)的狀態(標準狀態時溫度為298.15K)。氫標電極的溫度係數也因此為零。
實際測量時需用電勢已知的參比電極替代標準氫電極,如甘汞電極、氯化銀電極等。它們的電極勢是通過與氫電極組成無液體接界的電池,通過精確測量用外推去求得的。
在電化學發展的早期,研究人員曾使用一般氫電極作為零電位。這種電極的定義是“鉑電極浸在濃度為1M的一元強酸中,放出壓力約1atm的氫氣”。可見它能夠實際實現,因而使用很方便。然而,這樣的電極-溶液界面並不完全可逆,所以後來零電位的定義有所改變——新的定義是一個氫離子的活度為1mol/L的理想電極-溶液界面(即假設氫離子與其他微粒沒有任何相互作用,顯然現實中無法實現)。為了便於區分,這個新標準稱為“標準氫電極”。
一般氫電極(Normal Hydrogen Electrode,NHE):鉑電極在1M的強酸溶液中所構成的電極(歷史標準,現已棄用)。
標準氫電極(Standard Hydrogen Electrode,SHE):鉑電極在氫離子活度為1mol/L的理想溶液中所構成的電極(當前零電位的標準)。
可逆氫電極(Reversible Hydrogen Electrode,RHE)是電化學會用於表示電極電位是標準的“零電位”,該詞出自JPCC的一篇文章(J. Phys. Chem. C, 2009, 113 (28), pp 12340–12344 題目:Surface Decoration at the Atomic Scale Using a Molecular Pattern: Copper Adsorption on Cyanide-Modified Pt(111) Electrodes)。現在電化學論文中更多的採用RHE校正自己體系的參考電極,作為相互比較的通用單位。一般每個電化學體系的RHE稍有不同,比較講究的文章中Supporting Information有詳細的測定方法。
比如這篇文章 《An Oxygen Reduction Electrocatalyst Based on Carbon Nanotube-Nanographene Complexes》的supporting information 一開始就校正了電極電位,實驗本身使用的SCE(飽和甘汞)電極。具體的方法不再贅述。
在選擇用於標準氫電極的鉑時,應考慮如下幾個因素:
• 鉑的活潑程度(越不活潑自然越不會被腐蝕);
• 催化氫氣變為氫離子的反應的性能;
• 鉑固有的交換電流密度高低;
• 可逆性的高低(兩個完好的標準氫電極的電勢相差不超過10μV);
• 鉑表面是否有被鍍過(如鍍一層鉑黑)。這是為了:增大總的表面積。這會增大了反應的性能,加快反應速率;更好地吸附氫氣到表面上,同樣能夠加快反應速率。
其他的金屬也能用作電極並起到相似的作用,例如鈀。
由於鉑電極有極高的吸附性,避免電極與溶液和有機物或是大氣中的氧氣接觸是很重要的。有氧化性的無機物(如Fe、CrO等)同樣也要與電極隔離。
其他一些能使催化劑中毒的物質包括:含硫和含砷的物質、膠體、生物鹼以及一些生物體中的物質。
氘的電極反應方程式如下:
2D(aq) + 2e→ D(g)
其電極電勢與氫的略有差異(約-0.013V,不同的文獻給出的數據各不相同,如也有-0.044V等說法)。
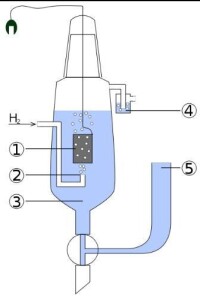
如圖為測量電極電勢的裝置,圖中裝置用於測量某一工作電極的電極電勢。其中各數字代表含義如下:
1.鉑黑電極。
2.氫氣於此處噴出。
3.H活度為1mol/L的酸溶液。
4.水封,防止氧氣干擾實驗。
5.連接到另一工作電極。可以直接連通,也可以使用鹽橋,選擇何者取決於另一電極的電解液。若減小管徑,可以減小混合的程度。
標準氫電極