氯化銀
銀的氯化物
氯化銀是銀的氯化物,由可溶的銀化合物如硝酸銀與氯離子反應獲得。氯化銀在電化學中非常重要的應用是銀-氯化銀-參比電極。氯化銀是白色粉末,見光變紫並逐漸變黑。25℃時水中溶解度為1.93mg/L,鹽酸能減少其在水中溶解度,溶於氨水、氰化鈉、硫代硫酸鈉、硝酸汞溶液,不溶於乙醇和稀鹽酸。

氯化銀
熱力學數據:
ΔfH0 s:-127kJ/mol
S0 s:96J/(mol · K)
顏色:白色,在光作用下顏色會變深 (見光變紫色並逐漸變黑)。
溶解性:易溶於濃氨水、硫代硫酸鈉溶液、氰酸溶液(在這些溶液中它形成[Ag(NH3)2]+ 、[Ag(S2O3)2]3− 和[Ag(CN)2]− 等。)。
不易溶於有機溶液。
不溶於:水、乙醇,硝酸,硝酸銀。
見光易分解,開始變灰,最後變黑。溶於氨水、硫代硫酸鈉或氰化鉀溶液,分別形成穩定的配離子(見配位化合物)。
和金屬反應
2AgCl+Zn=ZnCl2+2Ag
AgCl懸濁液中還是有銀離子的,所以鋅(Zn)可以與銀離子反應,置換出銀,所以AgCl懸濁液能和Zn反應。
生成硫化銀的反應
2AgCl+Na2S=Ag2S+2NaCl
硫化銀的溶解度比氯化銀還小,根據沉澱轉化的原理,氯化銀可以和硫離子反應生成硫化銀。
在氨溶液中的溶解
AgCl+ 2NH3 -→ [H3N-Ag-NH3]+ + Cl−
與其它鹵化銀鹽如AgBr和AgI不同的是氯化銀能夠溶解在稀的氨溶液中,在氰酸溶液中氯化銀也能溶解並形成類似的複合物。在濃鹽酸中氯化銀可以形成[Cl-Ag-Cl]-,因此有限可溶。
在氨溶液中加入硫化物又可以形成不可溶的銀鹽:
2[Ag(NH3)2]+ + S2− ==Ag2S + 4 NH3
由於硝酸銀溶於水中,在不斷攪拌下,加入純鹽酸,生成白色氯化銀沉澱,立即過濾,吸干,用水反覆洗滌至無硝酸根為止,70℃烘乾製得。全部合成工作均應在暗室進行,以免產品遇光分解。產品應儲存在棕色玻璃瓶中。
NaCl+AgNO3=AgCl↓+NaNO3
HCl+AgNO3=AgCl↓+HNO3
照相
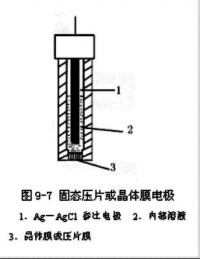
Ag/AgCl-電極
在大自然中氯化銀以角銀礦的形式出現。由於氯化銀非常不易溶,因此在實驗室中它常被用來測定樣品的含銀量。
氯化銀可用於製造電池,以及光學和藥學等方面。
氯化銀在電化學中非常重要的應用是銀-氯化銀-參比電極。這種電極不會被極性化,因此可以提供精確的數據。
由於實驗室中越來越少使用汞,因此Ag/AgCl-電極的應用越來越多。用氯化銀提取金屬單質銀。
這種電極可以使用電化學氧化的方式在鹽酸中製作:比如將兩根銀線插入鹽酸中,然後在兩根線之間施加一至二伏電壓,陽極就會被氯化銀覆蓋(陽極反應:2 Ag + 2 HCl→2 AgCl + 2 H ++ 2 e-,陰極反應:2 H + 2e-→H2,總反應:2 Ag + 2 HCl → 2AgCl + H2)。使用這個方式可以確保氯化銀只在電極有電的情況下產生。
皮膚接觸:流動水洗凈即可。
眼睛接觸:用流動水清洗即可。
