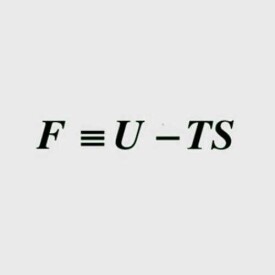亥姆霍茲能
亥姆霍茲能
亥姆霍茲能F定義為: 其中 U是系統的內能,T為熱力學溫度,S為熵。
根據熱力學第一定律及熱力學第二定律:在等溫(系統的始態溫度、終態溫度 和環境的溫度 相等,即 )的情況下,溫度T為常數,則此時,存在或式中不等號表示不可逆過程,等號表示可逆過程。由此可知,在等溫過程中,一個封閉體系所能做的最大功等於其亥姆霍茲能的減少。因此,亥姆霍茲能可以理解為等溫條件下體系作功的本領。
封閉系統在等溫條件下系統亥姆霍茲能減少,等於可逆過程系統所作的最大功;若是不可逆過程,系統亥姆霍茲能的減少恆大於不可逆過程的功。
亥姆霍茲能是狀態函數,只要狀態一定,其值就一定,而不在乎是否發生的是等溫或是可逆過程。只是在等溫可逆過程中,系統所做的最大功(-W)才等於亥姆霍茲能的減少。
系統在等溫等容,無非體積功的條件下,,此時
即系統在等溫等容,無非體積功的條件下,封閉系統自發變化總是朝著亥姆霍茲能減少的方向進行,這就是最小亥姆霍茲能原理。因此,根據亥姆霍茲能的變化,即可判斷過程的自發情況。
當此時為自發過程;
當 此時為可逆過程或處於平衡狀態;
當為不能自發進行的過程。