電壓鉗
電壓鉗
電壓鉗(voltageclamp)又叫電壓鉗制或電壓固定,該技術由Cole和Marment設計,后經Hodgkin和Huxley改進並成功地應用於神經纖維動作電位的研究。
其設計原理是根據離子作跨膜移動時形成了跨膜離子電流(I),而通透性即離子通過膜的難易程度,其膜電阻(R)的倒數,也就是膜電導(G)。因此,膜對某種離子通透性增大時,實際上時膜電阻變小,即膜對該離子的電導加大。根據歐姆定律V=IR,即I=V/R=VG,所以,只要固定膜兩側電位差(V)時,測出的跨膜電流(I)的變化,就可作為膜電導變化的度量,即可了解膜通透性的改變情況。
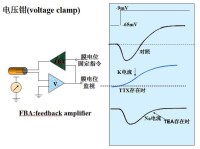
電壓鉗
電壓鉗的缺點:電壓鉗技術目前主要用於巨大細胞的全細胞電流研究,特別在分子克隆的卵母細胞表達電流的鑒定中發揮其它技術不能替代的作用。但也有其致命的弱點:
1、微電極需刺破細胞膜進入細胞,以致造成細胞漿流失,破壞了細胞生理功能的完整性;
2、不能測定單一通道電流。因為電壓鉗制的膜面積很大,包含著大量隨機開放和關閉著的通道,而且背景噪音大,往往掩蓋了單一通道的電流。
3、對體積小的細胞(如哺乳類中樞神經元,直徑在10-30μm之間)進行電壓鉗實驗,技術上有更大的困難。由於電極需插入細胞,不得不將微電極的尖端做得很細,如此細的尖端致使電極阻抗很大,常常是60~8OMΩ或120~150MΩ(取決於不同的充灌液)。這樣大的電極阻抗不利於作細胞內電流鉗或電壓鉗記錄時在短時間(0.1μs)內向細胞內注入電流,達到鉗制膜電壓或膜電流之目的。再者,在小細胞上插入的兩根電極可產生電容而降低測量電壓電極的反應能力.
