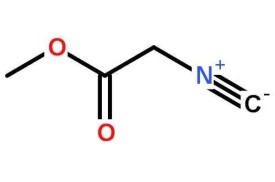
氰基
氰基
氰基,是指碳原子和氮原子通過叄鍵相連接的基團,化學式為-CN。這一叄鍵給予氰基以相當高的穩定性,使之在通常的化學反應中都以一個整體存在。因該基團具有和鹵素類似的化學性質,常被稱為擬鹵素。通常人們所了解的氰化物都是無機氰化物,俗稱山奈(來自英語音譯“Cyanide”),是指包含有氰根離子(CN-)的無機鹽,可認為是氫氰酸(HCN)的鹽,常見的有氰化鉀。
[英]cyan
和氰化鈉。它們多有劇毒,故而為世人熟知。另有有機氰化物,是由氰基通過單鍵與另外的碳原子結合而成。視結合方式的不同,有機氰化物可分類為腈(C-CN)和異腈(C-NC),相應的,氰基可被稱為腈基(-CN)或異腈基(-NC)。
氰化物擁有令人生畏的毒性,然而它們絕非化學家的創造,恰恰相反,它們廣泛存在於自然界,尤其是生物界。氰化物可由某些細菌,真菌或藻類製造,並存在於相當多的食物與植物中。在植物中,氰化物通常與糖分子結合,並以含生氰糖苷(cyanogenic glycoside)形式存在。比如,木薯中就含有含生氰糖苷,在食用前必須設法將其除去(通常靠持續沸煮)。水果的核中通常含有氰化物或含生氰糖苷。如杏仁中含有的苦杏仁苷,就是一種含氰糖苷,故食用杏仁前通常用溫水浸泡以去毒。
氰化物

聚丙烯腈
其毒性跟CN離子對重金屬離子的超強絡合能力有關。CN 主要跟細胞色素P450中的金屬離子結合,從而使其失去在呼吸鏈中起到的傳遞電子能力,進而使中毒者死亡。氰化物中毒一般都很迅速。臨床上常用的搶救方法是用硫代硫酸鈉溶液進行靜脈注射,同時使那些尚有意識的病人吸入亞硝酸異戊酯進行血管擴張來克服缺氧。常見的氰化物中毒原因是誤食含氰果仁兒,比如生桃仁兒等。
繼前蘇聯切爾諾貝利核污染之後,又一場巨大環境災難降臨在歐洲大地。2000年的1月30日深夜至31日晨,羅馬尼亞北部邊境城鎮奧拉迪亞,連續幾天幾夜的大雨使鎮上烏魯爾金礦用於生產黃金的氰化物廢水漫過大壩向下游洶湧衝去。這股“死亡之水”所經之處,所有生物在極短的時間內暴亡,流經羅馬尼亞、匈牙利和南聯盟的歐洲大河之一蒂薩河及其支流內的80%魚類已完全滅絕,而且這股毒水還流入了歐洲最著名的藍色河流--多瑙河,使當地居民深感痛惜,他們在蒂薩河、多瑙河的多處大橋上插上一面面黑旗、燃著一支支蠟燭,無奈而又憤怒的一朵朵潔白的小花投到河裡,為河流的“死亡”而默默地哀悼。
氰化物廢水何以造成如此巨大的環境災難呢?下面談談有關氰化物的知識。
一、氰化物的應用
氰化物是指氫氰酸(HCN)的鹽類,它廣泛用於電鍍、冶金、合成醫藥等方面。
氰化物中鹼金屬氰化物易溶於水,水解呈鹼性:
CN-+H2O=HCN+OH-
重金屬氰化物難溶於水,但由於CN-的強配合作用,故而在鹼金屬氰化物中變得可溶了。所以,NaCN、KCN被用於從礦物中提取金和銀。
烏魯爾金礦是由澳大利亞一家金礦公司和羅馬尼亞一家公司合資開採。具體方法是:
先用NaCN或KCN的稀溶液處理粉碎的礦石,然後用Zn進行置換,使金從溶液中析出,有關反應可表示為:
4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH
2Na[Au(CN)2]+Zn=2Au+Na2[Zn(CN)4]
提取金以後的氰化物廢水流入廢液池中等待進一步處理,而露天的氰化物廢液池在大雨的連續浸襲后,漫池壩而過才釀成了這次歐洲環境大災難。
氫氰酸和氰化物都有劇毒,而且中毒非常迅速。它們可以通過多種途徑進入人體,如皮膚吸收、傷口侵入、呼吸道吸入、誤食等,而水質和環境的污染使人和其他生物體被動吸收更是防不勝防。進入人體后,它能使中樞神經系統癱瘓,使呼吸酶及血液中血紅蛋白中毒,引起呼吸困難,全身細胞會因缺氧窒息而使機體死亡。氰化物的中毒很少量就能使人致死,例如,氰化鈉的致死量為0.05g。
歐洲環境大災難中所有生物短時間內暴亡,僅死亡的魚類就達100多萬噸,由此可見氰化物毒性之一斑。
為保護我國人民的身心健康,環保部門制訂了電鍍、冶金、煤氣等工業廢水中CN-容許排放的最高濃度為0.0005g/L。
氰化物進入機體後分解出具有毒性的氰離子(CN-),氰離子能抑制組織細胞內42種酶的活性,如細胞色素氧化酶、過氧化物酶、脫羧酶、琥珀酸脫氫酶及乳酸脫氫酶等。其中,細胞色素氧化酶對氰化物最為敏感。氰離子能迅速與氧化型細胞色素氧化酶中的三價鐵結合,阻止其還原成二價鐵,使傳遞電子的氧化過程中斷,組織細胞不能利用血液中的氧而造成內窒息。中樞神經系統對缺氧最敏感,故大腦首先受損,導致中樞性呼吸衰竭而死亡。此外,氰化物在消化道中釋放出的氫氧離子具有腐蝕作用。吸入高濃度氰化氫或吞服大量氰化物者,可在2-3分鐘內呼吸停止,呈“電擊樣”死亡。
由於氰化物有劇毒性,因此對於含氰化物的廢水以及一旦造成氰化物的污染必須加以處理。
處理的方法主要是利用CN-的性質:
工業上可加入FeSO4使之生成無毒物質,可表示為:
FeSO4+6NaCN=Na4[Fe(CN)6]+Na2SO4
CN-的還原性比I-弱,比Br-強,可被NaClO,Cl2等氧化劑所氧化,可表示為:
NaClO+NaCN=NaCNO+NaCl(NaCNO無毒)
5Cl2+10NaOH+2NaCN=2NaHCO3+N2↑+10NaCl+4H2O
歐洲這次環境大災難,受污染的歐洲各國立即召開了緊急會議,沿河各大小城鎮都成立了緊急指揮中心,制訂了最大限度地減少被污染的河水造成的對環境的災難性破壞的具體措施。
但是處理和補救只能減少污染所造成的危害,也是事後的一種無可奈何的選擇,而已經造成的損失卻難以彌補。環境專家說,這次歐洲環境災難要想完全恢復這裡的生態平衡,至少需要20年的時間。因此,更重要的是要通過這次環境災難,警醒保護環境的重要性,提高世界人民以及我國人民的環境意識,保護好我們賴以生存的環境。
事實上,歐洲的這次環境災難是羅馬尼亞環保工作未受到應有的重視,政府至今未設環保基金,環保專業人員嚴重不足,公民環保意識淡薄。據消息說,這次金礦的氰化物泄漏並非因為雨水過大水位暴漲而溢出,而是因為氰化物廢液池的堤壩決口所致。金礦公司不承認是堤壩決口所致,只不過是想推卸部分責任。
由碳和氮兩種原子組成一價原子團—C≡N或—CN。無機化合物中的氰化物(如氰化鈉)以及有機化合物中的烴基腈(如丙烯腈)和氰基酸(如氰基乙酸)等分子中都含有這種原子團。