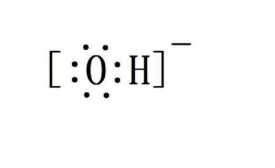氫氧根
氫氧根
氫氧根(化學式:OH-)是一種化合價為-1價的根,能和氫離子(H+)結合成水分子,遇銨根離子(NH4+)即生成氨氣和水。一個氫氧根由氫、氧各一個原子構成,不是一個原子,因此沒有獨立的相對原子質量
一般來說,金屬元素的氫氧化物顯鹼性,非金屬元素的氫氧化物顯酸性(除NH4+與OH-的結合,顯鹼性)。
根據阿侖尼烏斯提出的酸鹼離子理論作出的定義,在水中電離出的陰離子僅為氫氧根的物質即為鹼(如氫氧化鈉NaOH)。
常見氫氧化物有氫氧化銨(NH4OH),氫氧化鋇Ba(OH),氫氧化鈣Ca(OH),氫氧化鈷Co(OH),氫氧化鉀(KOH),氫氧化金Au(OH),氫氧化鋰(LiOH或LiOH·H2O ),氫氧化鋁Al(OH),氫氧化鎂Mg(OH),氫氧化鈉(NaOH),氫氧化鈹Be(OH) ,氫氧化氫(HOH),氫氧化鍶Sr(OH),氫氧化鐵Fe(OH),氫氧化銅Cu(OH),氫氧化鋅Zn(OH),氫氧化亞鐵Fe(OH)等。
檢驗:滴加甲基橙試液;無色酚酞試液(滴加后變紅);紅色石蕊試液(滴加后變為藍色)或蘸取滴在pH試紙(濃度越深,顏色越深,為深藍色)上。
氫氧根的離子半徑為:1.37 Å
鹼(在水中電離出的陰離子僅為氫氧根的物質)的化學式書寫
如氫氧化鋇
由於鋇的化合價是+2價,氫氧根的化合價是-1價
因此氫氧化鋇的化學式為Ba(OH)2
氫氧根與羥基存在本質區別,(1)氫氧根是由H和O組成的集團離子,羥基是由H和O組成的集團原子,(2)氫氧根永遠相當於一個單獨的離子,而羥基有時相當於一個單獨的原子,有時又可拆開,例如2C2H5OH + 2Na==2C2H5ONa + H2
氫氧根除自身氫氧原子成鍵外,還帶有一個來自外界的電子,從而使氫氧根中兩個原子都達到最外層飽和結構,所以氫氧根可以在溶液中大量地單獨穩定存在;
羥基只是自身氫氧原子成鍵,還缺少一個電子達到飽和,所以必須以官能團形式與其他原子團結合而無法單獨穩定地存在。