二氧化鋯
鋯的主要氧化物
二氧化鋯(化學式:ZrO2),是鋯的主要氧化物,通常狀況下為白色無臭無味晶體,難溶於水、鹽酸和稀硫酸。一般常含有少量的二氧化鉿。化學性質不活潑,但高熔點、高電阻率、高折射率和低熱膨脹係數的性質,使它成為重要的耐高溫材料、陶瓷絕緣材料和陶瓷遮光劑,亦是人工鑽的主要原料。能帶間隙大約為5-7eV。

二氧化鋯可用作鑽石的替代品
分子結構:低溫時為單斜晶系,在1100℃以上形成四方晶型,在1900℃以上形成立方晶型。
由灼燒二氧化鋯水合物或揮發性含氧酸鋯鹽所得的二氧化鋯為白色粉末,不溶於水;經由輕度灼燒所得的二氧化鋯,比較容易被無機酸溶解;強熱灼燒所得的二氧化鋯只溶於濃硫酸和氫氟酸;經過熔融重結晶的二氧化鋯只與氫氟酸作用。
二氧化鋯是一種兩性氧化物,與鹼共熔可形成鋯酸鹽,但鋯酸鹽遇水容易水解為ZrO2·xH2O而沉澱。
二氧化鋯與碳和氯氣高溫反應,或者與四氯化碳反應,生成四氯化鋯及二氯氧化鋯,水解又得到二氧化鋯。它在電弧中與碳作用生成碳化鋯。
一般用途
金屬鋯及其化合物的原料
用於制金屬鋯和鋯化合物、制耐火磚和坩鍋、高頻陶瓷、研磨材料、陶瓷顏料和鋯酸鹽等主要用於壓電陶瓷製品、日用陶瓷、耐火材料及貴重金屬熔煉用的鋯磚、鋯管、坩堝等。也用於生產鋼及有色金屬、光學玻璃和二氧化鋯纖維。還用於陶瓷顏料、靜電塗料及烤漆。用於環氧樹脂中可增加耐熱鹽水的腐蝕。
耐火材料

以二氧化鋯冒充水晶
燃氣輪機
等離子噴塗二氧化鋯熱障塗層在航空及工業用燃氣輪機上的應用已有很大進展,在一定限度內已經用於燃氣輪機的渦輪部分。由於這種塗層可以降低氣冷高溫部件的溫度50-200℃,因此可以顯著地改善高溫部件的耐久性,或者容許提高燃氣溫度或減少冷卻氣體的需用量而保持高溫部件所承受的溫度不變,從而提高發動機的效率。
陶瓷材料
因為氧化鋯的折射率大、熔點高、耐蝕性強,故用於窯業原料。壓電陶瓷製品有濾波器、揚聲器超聲波水聲探測器等。還有日用陶瓷(工業陶瓷釉藥)、貴重金屬熔煉用的鋯磚及鋯管等。納米級氧化鋯還可以用作拋光劑、磨粒、壓電陶瓷、精密陶瓷、陶瓷釉料和高溫顏料的基質材料。
其他
此外氧化鋯可用於白熱煤氣燈罩、搪瓷、白色玻璃、耐火坩堝等的製造。X射線照相。研磨材料。與釔一起用以製造紅外線光譜儀中的光源燈,厚膜電路電容材料,壓電晶體換能器配方。
以二氧化鋯粉末為原材料,經化工場熔爐再結晶而製成人工合成品,冒充天然水晶,成本僅20港幣。
1.氯氧化鋯熱解法:鋯英石與燒鹼在650℃熔融,熱水浸出熔融體,硅呈硅酸鈉形態與鋯酸鈉分離。再用硫酸處理,得硫酸鋯溶液,進一步除雜質后加氨水,沉澱出氫氧化鋯。加鹽酸溶解氫氧化鋯,得到氯氧化鋯,經蒸發濃縮、冷卻結晶、粉碎、焙燒,即得二氧化鋯成品;另外,還可以將易提純的鋯化合物熱分解或氧化分解,以製備高純氧化鋯。
2.膠體法:在氧化鋯溶液中,加入二氧化硅溶膠配成膠體溶液,經噴吹、拉絲法成型,經乾燥后燒結成纖維。
3.擠壓法:將氧化鋯溶膠或氧化鋯粒子和增稠劑製成坯,利用液壓或利用螺旋絞刀的推進作用將坯料從機型口擠出並成細絲,再經燒結固化即成纖維。該法製得的纖維較粗,纖維的強度也較低。
4.浸漬法:先將黏膠絲或整個織物長時間浸泡在氫氧化鋯溶液中,使黏膠纖維溶脹,然後經熱解、煅燒即得到具有一定拉伸強度的氧化鋯纖維。
5.水解法:以氧氯化鋯為原料水解製備高純超細二氧化鋯,將0.2-0.3mol/L的高純氧氯化鋯溶液加去離子水水解,並長時間煮沸氧氯化鋯溶液,使水解生成的氯化氫不斷蒸發除去,水解反應在沸騰下進行50h以上,再過濾,用去離子水洗、乾燥、煅燒粉碎,製得產品。
6.高溫水解法:將1mol/L的高純氧氯化鋯溶液噴入溫度為1000℃的分解爐中,微小的氧氯化鋯液滴先是水分蒸發,然後水解生成二氧化鋯。分解后的二氧化鋯經旋風分離器收集,再經酸洗、水洗、烘乾,得產品。
7.溶膠-凝膠法:在鋯醇[ZrO(C3H7)4]中加入醇和水,再加入催化劑,經充分混合后,開始分解,放置使其膠化及成黏稠液體,選擇適當黏度,進行乾燥再加熱至500-1000℃,高溫度纖維化燒成即得產品。
8.醇鹽水解法:以四氯化鋯、氨和丙醇為原料製備高純超細二氧化鋯,在苯溶劑存在下將高純四氯化鋯和丙醇、氨於5℃反應製得鋯醇鹽,經過濾分離除去氯化銨,再加水水解沉澱、過濾,不小於100℃乾燥、煅燒、粉碎得產品,水解條件直接影響產品粒徑、形狀和凝聚狀況。該法可製得粒子大小和形狀均勻、結構相單一的ZrO2。
9.將氧氯化鋯(ZrCl2O·8H2O)用鹽酸或甲醇重結晶,經高溫煅燒,製得成品。
10.將四烷氧基鋯蒸餾提純,其蒸氣在350-500℃分解,得成品。
11.將四氯化鋯蒸餾提純,其蒸氣與過量氧氣在1200℃反應,得二氧化鋯。
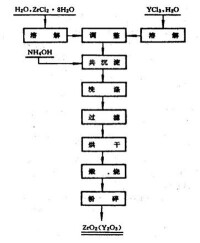
工業用耐火材料的穩定氧化鋯,大多數用電熔法製取。在鋯英石電熔過程中加入碳及穩定劑氧化鈣,在除硅的同時,氧化鋯和氧化鈣作用生成固溶體,再經粉碎和整粒處理,即可製得穩定氧化鋯。精細陶瓷所用的穩定和部分穩定氧化鋯一般採用濕法製取。目前最成熟和常用的是中和沉澱法,其製取工藝見圖。將提純過的氯氧化鋯用純水溶解,過濾除去不溶物,調整溶液中的鋯濃度,並加入需要量的氯化釔溶液(或其他稀土金屬或鹼土金屬的氯化物溶液)后,加氨水中和沉澱。沉澱物用熱水洗滌后,再經過濾、乾燥和煅燒。煅燒產品經粉碎等處理便可獲得超微細的穩定氧化鋯粉末。
部分穩定氧化鋯是控制加入穩定劑的量,使其不足以達到完全穩定而製得的。部分穩定氧化鋯具有高強度和抗熱震性能,在結構陶瓷中有著相當廣泛的用途。
應貯存於乾燥庫房中,不可與強鹼類物品共貯混運。
二氧化鋯
危險品標誌:Xi Irritant
刺激性物品RTECS號:ZH8800000
R36刺激眼睛。
R37刺激呼吸系統。
R36/37刺激眼睛和呼吸系統。
R36/37/38刺激眼睛、呼吸系統和皮膚。
S26不慎與眼睛接觸后,請立即用大量清水沖洗並徵求醫生意見。
S36穿戴適當的防護服。
S39戴護目鏡或面具
危險品運輸編號:UN1993 3/PG3
危險類別:3
