拷貝數
拷貝數
拷貝數,是指某基因(可以是質粒)在某一生物的基因組中的個數。單拷貝就是該基因在該生物基因組中只有一個,多拷貝則指有多個。在細菌細胞中,根據複製特性,質粒分嚴緊型和鬆弛型兩類,前者在細胞中只含1〜2個,而後者含10〜15個以上。恆定的拷貝數與質粒複製控制系統、宿主細胞遺傳背景及生長條件有關。
拷貝數變異(Copy number variation, CNV)是由基因組發生重排而導致的, 一般指長度為1 kb 以上的基因組大片段的拷貝數增加或者減少, 主要表現為亞顯微水平的缺失和重複。
(一)在細菌細胞中,某種特定質粒的數目。根據複製特性,質粒分嚴緊型和鬆弛型兩類,前者在細胞中只含1~2個,而後者含10~15個以上。恆定的 拷貝數與質粒複製控制系統、宿主細胞遺傳背景及生長條件有關。質粒複製控制系統首先通過調節複製的起始點來控制拷貝數,調節因素包括阻遏蛋白、反義RNA和某些順向重複序列。有些質粒還有其他控制系統,如有分配功能的par系統和確保質粒穩定遺傳的ccd系統。一旦質粒上與調控有關的基因或位點突變,可使拷貝數明顯增加或減少。
(二)在細菌細胞中,某種特定基因的數目。
一般檢測方法有
若是測序結果,可選用censor軟體檢測相關拷貝數。
southern blot
Southern blot 是一種常用的 DNA 定量的分子生物學方法。其原理是將待測的 DNA 樣品固定在固相載體(硝酸纖維膜或尼龍膜)上,與標記的核酸探針進行雜交,在與探針有同源序列的固相 DNA 的位置上顯示出雜交信號,通過檢測信號的有無、強弱可以對樣品定性、定量,從而計算出轉入的拷貝數。 Southern 法準確性高、特異性強,但存在費時費力的缺點。另外,由於 Southern 法檢測不經過靶片段的擴增( PCR ),一般每個電泳通道需要 10-30 μ g 的 DNA ,在實際操作中就需要較大量的植物材料來提取 DNA ,而轉基因植物的愈傷組織在無菌條件下經過篩選、重新分化后一般都比較細弱,不宜大量取樣。如果外源基因在插入時發生基因重組,造成限制性酶切位點丟失, Southern 法也無法檢測到。這些因素都制約了 Southern 法在 T 0 代轉基因植物中檢測外源基因拷貝數的應用。
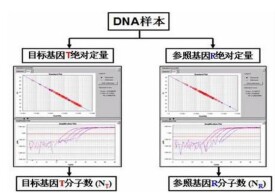
實時熒光定量PCR
其定量的基本原理是在 PCR 反應體系中加入非特異性的熒光染料(如: SYBR GREEN I )或特異性的熒光探針(如: Taqman 探針),實時檢測熒光量的變化,獲得不同樣品達到一定的熒光信號(閾值)時所需的循環次數: CT 值( Cycle Threshold );通過將已知濃度標準品的 CT 值與其濃度的對數繪製標準曲線,就可以準確定量樣品的濃度。熒光定量 PCR 技術具有簡便、快捷的優點,能夠有效擴增低拷貝的靶片段 DNA ,對每克樣品中 20pg-10ng 的轉基因成分進行有效檢測。同時,與 Southern 法相比,熒光定量 PCR 技術可對 T-DNA 的不同序列進行擴增,因此能實現對轉基因品系中的基因重組的檢測( Giovanna 2002 )。
數字PCR(Digital PCR)
數字PCR的基本原理是將含有核酸分子的反應體系分成成千上萬個納升級的微滴,其中每個微滴或不含待檢核酸靶分子,或者含有一個至數個待檢核酸靶分子,且每個微滴都作為一個獨立的PCR反應器。經PCR擴增后,採用微滴分析儀逐個對每個微滴進行檢測,有熒光信號的微滴判讀為1,沒有熒光信號的微滴判讀為0(因此該技術被稱為“數字PCR”),最終根據泊松分佈原理以及陽性微滴的比例,分析軟體可計算給出待檢靶分子的濃度或拷貝數(無需標準曲線的繪製)。