江蘇延申生物科技股份有限公司
江蘇延申生物科技股份有限公司
江蘇延申生徠物科技股份有限公司坐落於人傑地靈的長三角腹地——常州,其註冊地址為國家級高新技術開發區。
該公司成立於1995年4月,1996年10月取得藥品生產許可證,是江蘇省內首家集研發、生產、銷售為一體的疫苗類高科技企業,註冊資本為6518萬元,公司總佔地面積為21930平方米,建築面積為19200平方米,其中通過國家食品藥品監督管理局GMP認證的廠房實驗室共計10000多平方米,凈化車間5000多平方米。公司主營業務為疫苗(氣管炎疫苗、癤病疫苗),疫苗〔人用狂犬病疫苗(vero細胞)〕、免疫製劑(短棒桿菌注射液),流感病毒裂解疫苗製造。
2003年4月,深圳瑞盟鑫投資有限公司及深圳盟源投資有限公司以增資重組的方式,取得了該公司90%的股權。自重組以來該公司已連續三年保持100%以上的增長速度。
致力於疫苗產業發展,為全人類的疾病預防控制作出貢獻。
管理現代化,生產規範化,銷售網路化,品牌國際化。
精益求精,點滴改進,持續改善,每天進步。
服務只有起點,沒有終點。
通過與各大院所等科研機構的廣泛交流合作,圍繞生物製藥產業這個軸心,以市 場為導向,不斷加大研發費用的投入,通過技術改造的方式,不斷開發新品,提升公司的核心競爭力。公司的新品研發主要採用自主研發與聯合開發相結合的方式,基礎研究由政府科研機構完成,利用企業技術人員熟悉工業化大生產的優勢,公司研發人員在中試階段進入,集中力量進行技術成果產業化研究。這樣的合作方式,一是擴展公司研發力量的外延,降低研發成本;二是長久深層次的合作,使公司能夠得到最前沿的研發成果和最新的技術信息;三是縮短技術成果產業化的進程,使新品能夠在較短時間內上市。
場為導向,不斷加大研發費用的投入,通過技術改造的方式,不斷開發新品,提升公司的核心競爭力。公司的新品研發主要採用自主研發與聯合開發相結合的方式,基礎研究由政府科研機構完成,利用企業技術人員熟悉工業化大生產的優勢,公司研發人員在中試階段進入,集中力量進行技術成果產業化研究。這樣的合作方式,一是擴展公司研發力量的外延,降低研發成本;二是長久深層次的合作,使公司能夠得到最前沿的研發成果和最新的技術信息;三是縮短技術成果產業化的進程,使新品能夠在較短時間內上市。

江蘇延申生物科技股份有限公司
目前公司員工超過450人,其中大專以上學歷的員工佔70%,中、高級專業技術人員100餘人,占員工總數的23%以上。公司堅持“以人為本”的原則,以事業感召人才。2003年以來陸續引進生物製藥方面的高級研發及管理專家,進一步提升了公司的技術優勢及管理水平;與此同時,公司也吸引到了國內上市公司和業內優秀的高級專業人才加盟,形成了集研發、生產、營銷為一體的優秀職工團隊。
根據公司產品的特點制定了“跟蹤國際,服務國內”的營銷戰略方針,並根據市場的需求情況,不斷完善市場網路體系,建立以省市為中心,地區為重點,縣級為輻射點的三級營銷體系。目前在全國設立了30餘個聯絡處,擁有140餘名專職市場推廣及售後服務人員。
2006年1月國家發改委公布《關於組織實施生物疫苗和診斷試劑高技術產業化專項的通知》,該通知為符合要求的產業化專項提供資金支持,這是在順應國家“十一五”對發展高新科技產業的要求下,給我國疫苗產業注入一劑強心針。這也是延伸生物發展史上的一個重大機遇,是歷史賦予的使命,必須發展,為全人類健康而發展。
2006年,董事會出於國際化戰略考慮,引進美國一家著名的生命科學投資公司,憑藉其深厚的行業背景為公司走向國際架起了橋樑,公司未來的發展之路會越走越寬。
公司經營層高度統一認識,一方面不斷加大科研投入,增強科研能力,大力開發新品,將公司的主營產品從品種不多的疫苗製品擴展為預防性、治療性疫苗製品的系列產品,不斷延伸生物產業鏈,提升公司核心競爭力。
同時大力拓展海內外市場,增加公司產品的覆蓋面,依靠優質的產品和良好的售後服務,不斷提升公司產品的知名度和美譽度,做大做強延申生物的品牌,力爭在3-5年內成長為國內疫苗產業的領軍型企業。
2008年,該公司被常州市新北區政府評為常州市工業投入十強企業;被常州市外經貿局評定為常州市企業技術中心。
2008年10月,該公司申報的省科技成果轉化項目“運用Vero細胞和多層瓶技術大規模生產純化甲型肝炎滅活疫苗(Vero細胞)”獲得科技專項資金逾千萬元支持。
2007年,該公司被常州市政府評為2007年度一星企業。
2007年12月,該公司研發中心被江蘇省科技廳確認為第四批江蘇省外資研發機構。
2007年10月,純化甲型肝炎滅活疫苗產業化項目分別被列為“江蘇省企業重點技術創新導向項目計劃”和“2007常州市重點工業科技發展計劃”。
2007年8月,由該公司和美國Bari公司承擔的“常州市大規模動物細胞培養工程技術研究中心”被常州市科技局列為“2007年常州市第十七批科技計劃項目”之一。
2007年4月,該公司申請的“單純皰疹病毒基因工程疫苗的研製”課題正式獲得國家科技部“863計劃”立項,課題編號為2006AA02A226。
2006年,該公司被評為常州市明星企業,董事長韓剛君被評為常州市優秀企業家。
2006年,該公司被新北區政府評為“2006年度上繳稅收先進企業”。
2006年10月,流行性感冒裂解疫苗被江蘇省科技廳認定為“江蘇省第三批高新技術產品”。
2006年3月,該公司承擔的“常州市大規模動物細胞培養工程技術研究中心”被市科技局列入“2006年常州市第十二批科技技術項目”。2007年8月,“中心”建設項目可行性研究報告通過專家論證。
2005年12月,該公司被評為常州市民營科技型企業。
2005年,該公司被常州市葯監局評定為“2005年度藥品質量安全信用守信AA級單位”。
2005年,該公司流感疫苗被科技部、商務部、環保局等單位評定為“國家重點新產品”。
2005年2月,該公司課題“生物製品流行性感冒裂解疫苗產業化”列入科技部“863計劃引導項目”。
2004年,該公司流感疫苗被科技部“科技型中小企業技術創新基金立項”。
1999年—2007年,該公司連續8年被江蘇省科技廳評定為“高新技術企業”。
1999年9月—2004年9月,該公司人用狂犬病疫苗被江蘇省科技委員會認定為“高新技術產品”。

江蘇延申生物科技股份有限公司
江蘇延申生物科技股份有限公司研製的甲型H1N1流感病毒裂解疫苗於2009年9月18日正式獲得了由國家葯監局核發的新葯證書(國葯證字S20090010)和生產批准文號【國葯准字S20090021(15μg/0.5ml/瓶;西林瓶)和國葯准字S20090022(15μg/0.5ml/支;預灌封注射器)】。延申生物成為目前全國6 家之一、江蘇省內唯一具備生產資質的甲型H1N1流感病毒裂解疫苗生產企業。
已生產的160萬人份甲型H1N1流感病毒裂解疫苗於2009年8月28日起陸續上報中檢所進行同步批簽發,預計9月下旬可取得130萬人份《批簽發合格證》,用於國家儲備。預計到今年底,公司累計可以生產出1000萬人份疫苗。
到目前為止,國家食品藥品監督管理局共批准了8家企業生產甲型H1N1流感疫苗,包括:北京科興生物製品有限公司、華蘭生物疫苗有限公司、長春長生生物科技股份公司、北京天壇生物製品股份有限公司、長春生物製品研究所、上海生物製品研究所、江蘇延申生物科技股份有限公司、浙江天元生物葯業股份有限公司。
繼5月份以2億元的價格參股江蘇延申生物科技股份有限公司37.5%股權后,紐交所上市企業先聲葯業再度增持後者股權至50.77%,這也是先聲葯業第一家控股的疫苗類企業。

江蘇延申生物科技股份有限公司
“ChinaVax是一個項目公司,這是一個技術性的安排。”任晉生表示,但他不願透露此次增持的具體金額。
江蘇延申是國內領先的從事疫苗研發和生產的公司,最近甲流疫情的蔓延,也讓公司的關注度迅速提升。今年9月18日,中國食品藥品監督管理局(SFDA)給江蘇延申甲型H1N1流感疫苗頒發新葯證書和生產許可,其後作為全國8傢具備生產資質的甲型H1N1流感疫苗生產企業之一,江蘇延申已經拿到工信部甲型H1N1流感疫苗630萬份訂單,在國家收儲企業中排名前三。
但任晉生指出,收購江蘇延申是先聲葯業的戰略性安排,符合公司的中長期戰略,並非是沖著眼下的甲流疫情來的。而且,甲流疫苗也只是江蘇延申主營業務的一部分。對於先聲而言,過去公司專註在腫瘤藥物和創新藥物領域的發展,與研發技術成熟、競爭異常激烈、強勢品牌全方位充斥的化學製劑領域相比,未來生物類新興藥品無疑具有非常廣闊的市場前景。
此次增股延申也是先聲繼收購上海賽金,投資超億元打造藥物研究院二期項目之後進軍生物製藥領域又一重要舉措,是先聲葯業進入中國疫苗產業實質性步伐。
“疫苗和抗體領域公司未來幾年會加大投入,培育成公司一個新的利潤增長點。”任晉生強調。
7.2萬枚雞蛋 僅產出8升“疫苗原漿”
江蘇第三批188萬劑疫苗31天後下線
延申生物坐落在常州市中吳大道上,從外表看規模並不大。昨天上午,經多方協調,省食品藥品監督管理局駐廠監督員殷強帶領記者參觀了疫苗生產線。記者穿上白大褂,戴上隔離帽,工作人員刷卡進入了生產樓,到了生產車間門口,換上白色帆布鞋,然後鑽進更衣室,取下手錶等一切暴露在外的物件,再套上“緊身隔離服”。每參觀一個樓層就要換一次衣服,記者前後共換了三套衣服,整個過程的大半時間都在手忙腳亂地換衣服。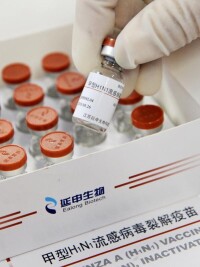 一跨進車間,記者還以為走錯了,“這分明就是雞蛋加工廠”,白花花的雞蛋一排一排的。“雞蛋是用於孵化甲流疫苗的,它們是經過孵化后的受精蛋,我們將其叫做雞胚。”殷強介紹。
一跨進車間,記者還以為走錯了,“這分明就是雞蛋加工廠”,白花花的雞蛋一排一排的。“雞蛋是用於孵化甲流疫苗的,它們是經過孵化后的受精蛋,我們將其叫做雞胚。”殷強介紹。

江蘇延申生物科技股份有限公司
江蘇產疫苗的“甲型H1N1流感病毒毒種”是世衛組織提供的,只有兩小支,工作人員將這兩支毒種傳代擴大製成工作種子批,稀釋后裝入自動接種機,將“毒液”注射進經檢驗和消毒的雞胚,要扎進雞胚的尿囊腔內,在33℃-35℃環境中經48小時培養后“甲流毒蛋”誕生,爾後經過一系列複雜的過程得到原液。
“從一個雞蛋變成甲流疫苗至少也要40天的時間。”延申生物的生產經理談女士說,她們每天消耗雞蛋7.2萬枚,但只能生產出8升“甲流疫苗原漿”,而8升原漿大概能生產8萬支疫苗。
徠目前,延申生物正開足馬力生產疫苗,月產量已達到220萬劑(瓶)。12月12日前將要發出一批,其中分配給江蘇188萬劑,安徽122萬劑,海南21萬劑,餘下150萬劑將作為國家儲備。
近日,有傳言稱,在第一批一線工作者接種甲流疫苗時,有許多人擔心甲流疫苗不安全,副作用可能潛伏10-20年,因此不願接種。對此,殷強表示,副作用主要來源於疫苗提純過程中殘餘的雞蛋“異性蛋白”,副作用半小時至三天之內會有體現,潛伏20年完全是謬論。
記者了解到,截至11月9日,江蘇接種疫苗的22萬多例中,發生副作用的僅有59例,其中49例是輕度發燒和針眼痛,17例出現一過性皮疹,1例惡針,1例心理性反應。
殷強對記者說:“甲流病毒收穫液在純化前含有很多雜質,包括雞胚中正常存在的異性蛋白(軟清蛋白)等。在經過透析濃縮過濾、離心等物理方式的純化后,異性蛋白的含量會大大減少,但不可避免仍有微量的殘留。有過敏體質的人,會對某種物質產生過度的反應,會將某些正常無害的物質誤認為有害的物質,導致機體發生過敏。”
“從目前的數據看,江蘇產疫苗的副作用率在萬分之五左右,在全國8家甲流疫苗生產企業中是最低的。”殷強非常肯定地說。
近日,總部在南京的先聲葯業繼今年5月斥資近2億元收購江蘇延申生物科技股份有限公司37.5%的股權后,通過收購其股東ChinaVax約74.49%的股份,得以擁有江蘇延申50.77%的股份,實現控股。
先聲葯業集團董事會主席兼首席執行官任晉生說:“中國疫苗產業的市場潛力巨大,我們很高興繼2009年5月參股江蘇延申37.5%股份后的五個月,繼續增加對江蘇延申的投資,這符合公司中長期戰略,這也是先聲葯業進入中國疫苗產業的實質性步伐。”
江蘇延申生物科技股份有限公司
目前,江蘇延伸已全面停產,其藥品GMP(優良製造標準)證書已被撤銷,7名公司高層因涉嫌生產銷售劣葯罪而被批准逮捕。
據悉,江蘇延伸在疫苗生產過程中攙入一種不易發覺的添加物,可以令出廠疫苗在一般檢測時達標,但實際效用卻大大降低。這一造假手法與三鹿公司在嬰兒奶粉中添加三聚氰胺相似,但其危害性卻有過之而無不及。
據國家葯監局調查組調查發現,江蘇延伸疫苗造假已非一兩日,在近年的產品中,保守估計一半以上的疫苗存在造假。
在美國紐約交易所上市的先聲葯業(Simcere)集團擁有江蘇延伸50.77%的股份。目前尚未有證據顯 示先聲葯業與疫苗造假行為存在關聯。
示先聲葯業與疫苗造假行為存在關聯。

江蘇延申生物科技股份有限公司
