分壓
名詞
“分壓”在物理學上的概念有氣體分壓(partial pressure)和電壓分壓兩種。氣體分壓是指假設從混合氣體系統中排除第i種氣體以外的所有其他氣體,而保持系統體積和溫度不變,此時氣體所具有的壓力,稱為混合氣體中第i種氣體的分壓。而電壓分壓是計算串聯的各個電阻如何去分總電壓,以及分到多少電壓的公式。
partial pressure
假設從混合氣體系統中排除第i種氣體以外的所有其他氣體,而保持系統體積和溫度不變,此時氣體所具有的壓強,稱為混合氣體中第i種氣體的分壓,即在給定溫度及體積下,僅一種i氣體單獨存在而充滿容器時的壓強。例如101.325kPa的乾燥空氣中,氮的分壓是79.193kPa,氧的分壓是21.198kPa。
混合理想氣體的總壓強等於各組分的分壓強的和,稱道爾頓分壓定律(J.Dalton,1766~1844,英)。
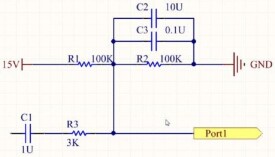
所謂分壓公式,就是計算串聯的各個電阻如何去分總電壓,以及分到多少電壓的公式。
分電壓多少這樣計算:佔總電阻的百分比,就是分電壓的百分比。公式是:U=(R/R總)×U源
如5歐和10歐電阻串聯在10V電路中間,5歐佔了總電阻5+10=15歐的1/3,所以它分的電壓也為1/3,也就是10/3伏特。
在任何容器內的氣體混合物中,如果各組分之間不發生化學反應,則每一種氣體都均勻地分佈在整個容器內,它所產生的壓強和它單獨佔有整個容器時所產生的壓強相同。也就是說,一定量的氣體在一定容積的容器中的壓強僅與溫度有關。例如,零攝氏度時,1mol 氧氣在 22.4L 體積內的壓強是 101.3kPa 。如果向容器內加入 1mol 氮氣並保持容器體積不變,則氧氣的壓強還是 101.3kPa,但容器內的總壓強增大一倍。可見, 1mol 氮氣在這種狀態下產生的壓強也是 101.3kPa 。
道爾頓(Dalton)總結了這些實驗事實,得出下列結論:某一氣體在氣體混合物中產生的分壓等於它單獨佔有整個容器時所產生的壓力;而氣體混合物的總壓強等於其中各氣體分壓之和,這就是氣體分壓定律(law of partial pressure)。
英國科學家約翰·道爾頓在19世紀初把原子假說引入了科學主流。他所提供的關鍵的學說,使化學領域自那時以來有了巨大的進展。確切地說,並不是道爾頓首先提出所有的物質都是由極其微小的、不可毀壞的粒子──人稱原子組成的。這個概念是由古希臘哲學家德漠克利特提出來的,甚至在他以前可能就有人提出過。另一位希臘哲學家伊壁鳩魯(公元前342—270年?)採用了這一假說。羅馬作家留克利希阿斯(公元前99?-55年)在他的著名詩歌《論事物的本質》中對這一假說做了生動形象的介紹。
德謨克利特的學說未被亞里士多德接受,在中世紀受到了忽視,對現代科學沒有什麼影響。但是17世紀有幾個包括艾薩克·牛頓在內的主要科學家支持過類似的學說。不過早期的原子學說都沒有定量表達,也沒有用於科學研究,最根本的是誰也沒有看到哲學的假想和化學的嚴酷事實之間存在的聯繫。
這就是道爾頓的貢獻所在。他提出了一個明了的定量學說,可以用來解釋化學實驗,並經受住了實驗室的精確檢驗。
雖然道爾頓的術語與我們現在使用的稍有不同,但是卻清楚地表述了原子、分子、元素等概念。他明確指出;雖然世界上原子的總數目相當之大,但是不同原子種類的數目卻是非常之小(他的原著中列出20種元素即20種原子,今天所知道的元素有一百多種)。
雖然不同種類的原子有不同的重量,但是道爾頓認為任何兩個同類原子的所有性質包括重量都相同。道爾頓在他的書中列出了一張各種不同類原子的相對重量表──有關這方面的第一張表,是定量原子學說的一個重要特徵。
道爾頓還明確地指出,任何相同化合物的兩個分子都是由相同原子組成的(例如,每個氧化亞氮都是由兩個氮原子和一個氧原子組成的)。由此可推出一種已知的化合物──不管是由什麼方法配製或在哪裡發現的──總含有相同的元素,而且這些元素之間的重量比完全一樣。這就是約瑟夫·路易斯·普勞特幾年前在實驗中發現的“定比定律”。
道爾頓的學說非常具有說服力,不到二十年的時間就為大多數科學家所採納。而且化學家按照書中所提出的方案行事:準確地確定出相對原子重量和每種分子的原子數;定量分析化合物。當然這個方案已取得徹底的成功。