配製溶液
配製成實驗需要濃度的溶液
在化學上用,化學物品和溶劑(一般是水)配製成實驗需要濃度的溶液的過程就叫做配製溶液。配製溶液前需要計算所需物品的多少並清理儀器。
c:濃度
n:物質的量
v:溶液體積
一、用液體試劑配製:
根據稀釋前後溶質質量相等原理得公式:
ω1:稀釋質量分數ρ1 :密度V1:欲配溶液體積
ω2:濃溶液質量分數ρ2:密度V2:需用濃溶液體積
例:要配製20%的硫酸溶液1000ml,需要96%的濃硫酸多少毫升?
查表知:20%時;96%時
代入公式:
二、物質的量濃度溶液的配製
1、根據稀釋前後溶質的量相等原則得公式:
C1: 稀釋前的濃度 V1:稀釋前體積
C2:稀釋后的濃度 V2:稀釋后體積
例:用的濃硫酸配製500ml,的稀硫酸,
需要濃硫酸多少毫升?
代入公式:
取的硫酸,在不斷攪拌下倒入適量水中,
冷卻后稀釋至500ml。
2、用固體試劑配製
公式:
m:需稱取的質量 C:欲配溶液濃度
V:欲配溶液體積 M:摩爾質量
例:欲配製的碳酸鈉溶液500ml,
該稱取多少克?
代入公式:
稱取26.5克碳酸鈉溶於水中稀釋至500ml。
3、用液體試劑配製
公式:
V1:原溶液體積 V2:欲配置溶液體積
d:比重 a:原溶液百分濃度
c:物質的量濃度 M:相對分子質量
例:欲配製的硫酸溶液500ml,應量
取重量百分濃度為98%,的硫酸多
少毫升?
代入公式:
1.計算:
例:實驗室用密度為,質量分數為36.5%,濃鹽酸配製250ml,的鹽酸溶液。
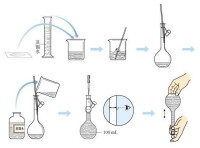
配製溶液
4.復溫:待溶液冷卻后移入容量瓶。
5.轉移(移液):由於容量瓶的頸較細,為了避免液體灑在外面,用玻璃棒引流,玻璃棒不能緊貼容量瓶瓶口,棒底應靠在容量瓶瓶壁刻度線下。
6.洗滌:用少量蒸餾水洗滌燒杯內壁2~3次,洗滌液全部轉入到容量瓶中。
7. 初混:輕輕搖動容量瓶,使溶液混合均勻。
8.定容:向容量瓶中加入蒸餾水,液面離容量瓶頸刻度線下時,改用膠頭滴管滴加蒸餾水至液面與刻度線相切。
9.搖勻,蓋好瓶塞反覆上下顛倒,搖勻,如果液面下降也不可再加水定容。
10.由於容量瓶不能長時間盛裝溶液,故將配得的溶液轉移至試劑瓶中,貼好標籤。
天平,葯匙,合適的量筒,玻璃棒,燒杯,合適的容量瓶,膠頭滴管。

配製溶液
2.要注意計算的準確性。
3.注意移液管的使用。
4.稀釋濃硫酸是把酸沿器壁慢慢注入水中,用玻璃棒不斷攪拌。
5.配好的溶液要及時裝入試劑瓶中,蓋好瓶塞並貼上標籤(標籤中應包括藥品名稱和溶液中溶質的質量分數(或摩爾分數)),放到相應的試劑櫃中。
——代表無影響:
| 對溶質的影響 | 對溶液體積的影響 | 對配成溶液濃度的影響 | |
| 稱量前燒杯內有水 | —— | 增大 | —— |
| 稱量時右物左碼 | 減小 | —— | 減小 |
| 用濾紙稱量氫氧化鈉固體 | 減小 | —— | 減小 |
| 向容量瓶移液時有少量濺出 | 減小 | —— | 減小 |
| 未洗滌燒杯和玻璃棒 | 減小 | —— | 減小 |
| 未冷卻就注入容量瓶 | —— | 減小 | 增大 |
| 容量瓶內原有水 | —— | —— | —— |
| 定容時超過刻度線 | —— | 增大 | 減小 |
| 定容時加水過多用滴管取出 | 減小 | —— | 減小 |
| 定容時俯視刻度線 | —— | 減小 | 增大 |
| 定容時仰視刻度線 | —— | 增大 | 減小 |
| 搖勻正放后發現液面未到刻度線再加水 | —— | 增大 | 減小 |
