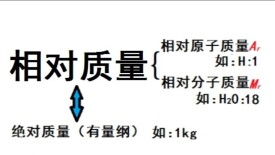
相對質量
相對質量
相對論相對質量分為相對相對分子質量和相對原子質量。
相對分子質量在數值上等於摩爾質量,但單位不同。相對分子質量的單位是1,而摩爾質量的單位是g/mol或g·mol。
化學元素的相對原子質量是重要的自然常數。兩個世紀以來,標準相對原子質量的確定皆為先進國家所貢獻。
我國化學家張青蓮與中國科學院肖應凱合作用質譜法精密地測定了銦(In)的相對原子質量,被國際原子量委員會於1991年8月漢堡會議上確定為新的標準相對原子質量。
● ● 相對分子質量在數值上等於摩爾質量,但單位不同。相對分子質量的單位是1,而摩爾質量的單位是g/mol。
● ● 相對分子質量最小的氧化物的化學式為H2O。
● ● 相對原子質量的符號為:(r為小寫下角標),不要與元素“氬(Ar)”混淆。相對分子質量的符號為。
● ● 核素的相對原子質量。核素是具有一定數目質子和一定數目中子的一種原子,核素的相對原子質量即原子的相對原子質量。原子的相對原子質量是科學上為了便於對微觀粒子的定量研究而規定的一個衡量標準。原子的相對原子質量的基本含義是:以一個碳-12原子質量的1/12作為標準,任何一種原子的平均原子質量跟一個碳-12原子質量的1/12的比值,稱為該原子的相對原子質量。
● ● 原子的近似相對原子質量。原子的質量主要集中在原子核上,因此通常情況下原子的近似相對原子質量等於其質量數。質量數在數值上等於原子中質子數和中子數之和,即A=Z+N。但質量數不只是微粒個數,它是一個屬於質量範疇的數值。質量數是對某種核素而言的,如Cl質量數是35。對於一種元素來說,沒有一種質量數跟它相對應,因此如果說氯元素的質量數是35,這種說法是錯誤的。
● ● 元素的相對原子質量。元素的相對原子質量是按該元素的各種天然同位素的相對原子質量和所佔的丰度(或原子物質的量分數)算出來的平均值。
● ● 元素的近似相對原子質量。元素的近似相對原子質量是按該元素的各種天然同位素的質量數和各原子所佔的丰度(或原子物質的量分數)計算出來的平均值。
由”原子的質量主要集中在原子核上“可以得到計算相對原子質量近似公式:
相對原子質量≈質子數+中子數(不能作為精確計算公式)
推導過程:
相對原子質量
=某種原子的質量/一種碳原子質量的(1/12)
=原子核質量+核外電子質量/[1/12]mC
≈原子核質量/(1/12)mC
=質子的質量+中子的質量/(1/12)mC
=[質子數×一個質子的質量+中子數×一個中子的質量]/(1/12)mC
=[質子數×(1/12)mC+中子數×(1/12)mC]/(1/12)mC
=質子數+中子數
註釋:①mC表示碳-12的質量;
一、求相對分子質量
格式為:XXX的相對分子質量=各元素數量×各元素相對原子質量=結果(初三考生要注意這裡一律以元素為單位分開計算,不能以原子團為單位整體計算,否則是沒有分的。)
【例1】:計算H2O的相對分子質量。
【解】:H2O的相對分子質量=1×2+16×1=18【注意這裡與摩爾質量不同,不可寫為M(H2O)】
【例2】:計算H2SO4的相對分子質量。
【解】:H2SO4的相對分子質量=1×2+32+16×4=98
二、計算組成物質的各元素的質量比
格式為:XXX中X元素與X元素質量比=(X原子個數×X相對原子質量):(X原子個數×X相對原子質量)
【例】:求二氧化碳碳氧元素質量比。
【解】:CO2中碳元素和氧元素的質量比=12:(16×2)=3:8
三、計算物質中某元素的質量分數
格式為:某元素的質量分數=(該元素分子的相對原子質量×原子個數)/(相對分子質量)×100%(這裡要注意寫上100%,否則公式錯誤,考試時公式分扣除。)
【例】:有MgO與MgSO4兩種物質的混合物,已知鎂的質量分數為33%,求氧化鎂質量分數。
【解】:設MgO質量分數x。
(x·Mg+(1-x)·Mg)/(x·MgO+(1-x)·MgSO4)=33%,解出X即為氧化鎂質量分數。