未成對電子
未成對電子
未成對電子,即不成對電子,指在分子軌道中只以單顆存在的電子,而不形成電子對。因成對的電子較為穩定,不成對電子在化學中是相對較罕見的,而具有不成對電子的原子則較易發生反應。在有機化學中,不成對電子通常都應用在自由基中,以解釋眾多的化學反應。
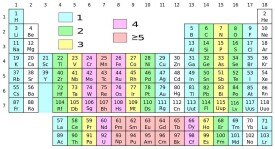
在d和f軌域中有不成對電子的自由基是較常見的,因這兩種軌域較不具方向性,因此不成對電子不能有效地形成穩定的二聚體。
鑭系元素中的不成對電子是最穩定的,它們的f軌域不太與外界反應,不成對電子更難形成化學鍵。具有最多不成對電子的原子是Gd,有七顆不成對電子。
電子對為位於同一分子軌道的一對電子。
根據泡利不相容原理、一原子中的電子不能有同一量子數,若電子要留在同一分子軌道中(主量子數、角量子數、磁量子數一致),需改變其自旋量子數。電子為費米子,其自旋為-1/2或+1/2,因此一分子軌道中只能有一對電子。
因在同一分子軌道中的電子對自旋方向相反,它們的磁矩會互相抵消。有時侯電子對受到外磁場影響,產生凈磁矩,形成抗磁性現象。
成對的電子較為穩定,但不成對電子也是存在的。
電子對有如下功用:
• 於原子間形成化學鍵;
• 作為孤電子對;
• 位於原子的核心軌域。
此外,即使電子不處於原子軌域中,它們在極低能量的狀態時會因電子間的微小引力而結合,成為庫柏對。
化學鍵(英語:ChemicalBond)是一種粒子間的吸引力,其中粒子可以是原子或分子。透過化學鍵,粒子可組成多原子的化學物質。鍵由兩相反電荷間的電磁力引起,電荷可能來自電子和原子核,或由偶極子造成。化學鍵種類繁多,其能量大小、鍵長亦有所不同。
在原子中,帶負電、繞原子核運行的電子與核內帶正電的質子互相吸引,而位於兩原子核之間的電子則皆受兩方吸引。因此,原子核和電子間最穩定的組態,是當電子位處兩原子核間之時。這些電子使原子核能夠彼此相吸,形成所謂的化學鍵。然而,化學鍵並不能減少個別粒子所構成的體積。由於電子的質量較小且具有物質波性質,它們相較於原子核而言佔據了極大部分的體積,使原子核之間距離較遠。
一般而言,強化學鍵的形成伴隨著原子間電子的共用或轉移。分子、晶體、金屬和雙原子氣體,事實上幾乎生活中所有外在環境,都是由化學鍵所維繫而來;它決定了物質的結構。
科學家認為“電子”是以一種稱為費米子(Fermions)的型態存在於物質空間之中,電子在原子之中時是以不同能階的原子軌域(AtomicOrbital)存在,氫原子光譜的實驗就是電子在不同能量原子軌域間存在的證明,由此可更進一步的推廣多電子原子的原子軌域,以及原子和原子形成分子的分子軌域理論(Molecular Orbital Theory)之理論模型,最後再利用量子化學中數學形式的條件限制,探討與解釋電子存在空間中的情況。
由微觀世界的眼光看來,分子所存在的空間即是其電子密度分佈所佔據的空間,化學家定義連結原子和原子成為分子的作用為“化學鍵”,以量子化學的觀念看來,化學鍵的形成主因是由於原子軌域的相互重疊,使得原有的軌域能階分佈改變,因而形成能量較穩定的分子軌域,也因此最直接影響化學鍵的形成因素就是電子密度的重新分佈。
利用電子密度之分佈可以找出兩個相鄰原子間電子密度極大值,其電子密度極大值的連線便是原子間化學鍵鍵結之路徑,進一步的利用原子間電子密度極大值的等位面加以分別原子所佔有的區域,可以界定出原子位於分子中所佔據的空間大小。