三角雙錐
五配體的構型之一
五配體有兩種構型,三角雙錐和四方錐,當然還存在變形的三角雙錐和變形的四方錐構型。
配合物的空間構型五花八門,但其基本規律是:
1)形成體在中間,配位體圍繞中心離子排布;
2)配位體傾向於盡可能遠離,能量低,配合物穩定。
不同配位數的配離子的立體構型:
配位數2,直線型;
配位數3,平面三角型,三角錐型;
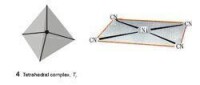
配位數4,正方形,四面體;
配位數5,三角雙錐,四方錐;
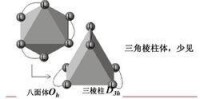
配位數6,八面體;
配位數8,四方反稜柱,12面體。
五配體有兩種構型,這兩種構型易於互相轉化,熱力學穩定性相近,例如在的結晶化合物中,兩種構型共存。這是兩種構型具有相近能量的有力證明。應當指出,配位教為5的分子要比配位數為4和6的化合物要少得多。如, 在氣相中是以三角雙錐的形式存在,但在固相中則是以四面體的離子和八面體的離子存在的。因此,在根據化學式寫出空間構型時,要了解實驗測定的結果,以免判斷失誤。
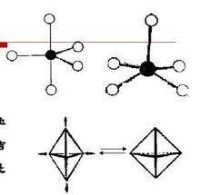
三角雙錐
四方錐(square pyramid,SP)
三角雙錐(trigonal bipyramid,TBP)
三角雙錐
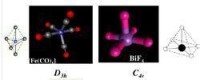
四配位是常見的配位,包括平面正方形和四面體兩種構型。
一般非過渡元素的四配位化合物都是四面體構型。因為採取四面體空間排列,配體間能盡量遠離,靜電排斥作用最小能量最低。但當除了用於成鍵的四對電子外,還多餘兩對電子時,形成平面正方形構型,此時,兩對電子分別位於平面的上下方。過渡金屬的四配位化合物既有四面體形,也有平面正方形,究竟採用哪種構型需考慮下列兩種因素的影響。( 1 ) 配體之間的相互靜電排斥作用;( 2 ) 配位場穩定化能的影響。
一般的,當4個配體與不含有電子構型的過渡金屬離子或原子配位時可形成四面體構型配合物。而 組態的過渡金屬離子或原子一般是形成平面正方形配合物。但具有組態的金屬若因原子太小,成配位體原子太大,以致不可能形成平面正方形時,也可能形成四面體的構型。
三角雙錐
八面體是最常見的構型。
三角雙錐
八面體變形的一種最普通的方式是四方形畸變,包括八面體沿一個四重軸壓縮或者拉長的兩種變體。(a)(b)是沿四重軸壓縮或者拉長。
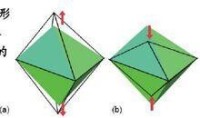
三角雙錐
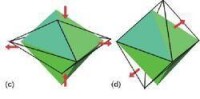
三角雙錐