共找到2條詞條名為配位數的結果 展開
- 化學概念
- 晶體學概念
配位數
化學概念
配位數,配位化學中是指化合物中中心原子周圍的配位原子個數,此概念首先由阿爾弗雷德·維爾納在1893年提出。配位數通常為2-8,也有高達10以上的,如鈾和釷的雙齒簇狀硝酸根離子U(NO3)6、Th(NO3)6,及研究的PbHe15離子,該離子中鉛的配位數至少為15。
配位數(coordination number)是中心離子的重要特徵。直接同中心離子(或原子)配位的離子數目叫中心離子(或原子)的配位數。
目錄
在配位化合物(簡稱配合物)中直接與中心原子連接的配體的原子數目。通常,配位數可以從2到9。如在配合物【Nb(H
O)
】和【ReH
】中配位數為9;在【Mo(CN)
】和【TaF
】中為8;在【ZrF
】和【NbF
】中為7;在【Ti(H
O)
】、【Co(NH
)
】中為6;在【CdCl
】和Fe(CO)
中為 5;在【BeCl
】、【Zn(CN)
】和Ni(CO)
中為4;在【HgI
】中為3;在【Ag(NH
)
】和【Au(CN)
】中為2。配位數為10或更高(11或12)的只在鑭系和錒系配合物中偶爾發現,是極少見的。影響配位數的因素如下:
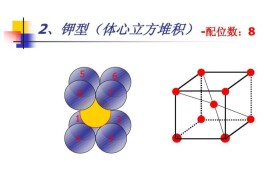
中心原子的大小中心原子的最高配位數決定於它在周期表中的周次。在周期表內,第1周期元素的最高配位數為2,第2周期元素的最高配位數為4,第3周期為6,以下為8、10。最高配位數是指在配合物中,中心原子周圍的最高配位原子數,實際上一般可低於最高數(表1)。由表可見,在實際中第1周期元素原子的配位數為2,第2周期不超過4。除個別例外,第3、4周期不超過6,第5、6周期為8。最常見的配位數為4和6,其次為2、5、8。配位數為奇數的通常不如偶數的普遍。

配位數
】、【CdCl
】和【InCl
】配離子。同一元素不同氧化態的離子常具有不同的配位數,例如,二價鉑離子Pt的配位數為4,而4價鉑離子Pt為6。這是因為中心離子的電荷愈高,就需要愈多的配體負電荷來中和。
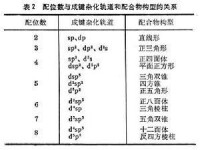
中心原子的成鍵軌道性質和電子構型從價鍵理論的觀點來說,中心原子成鍵軌道的性質決定配位數,而中心原子的電子構型對參與成鍵的雜化軌道的形成很重要,例如,Zn和Cu離子的5個3d軌道是全滿的,適合成鍵的是一個4s和3個4p軌道,經sp雜化形成4個成鍵軌道,指向正四面體的四個角。因此,Zn和Cu與CN生成配位數為4的配離子【Zn(CN)
】和【Cu(CN)
】,並且是正四面體構型(表2)。
配位數
】,而與F則生成配位數為 6的【FeF
】。這是因為 Fe從每個體積較大而較易極化的Cl接受的電荷要大於體積較小而較難極化的F。
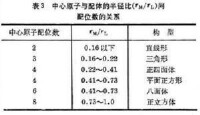
配合物的中心原子與配體間鍵合的性質,對決定配位數也很重要。在含F的配合物中,中心原子與電負性很高的F間的鍵合主要是離子鍵。如在B、Fe和Zr與F的配合物中,隨著中心原子半徑的增加,配位數分別為4、6和7,主要受中心原子與配體的半徑比的限制(表3)。很多配合物的中心原子與配體(例如CN、NO娛、SCN、Br、I、NH
和CO等)間主要形成共價鍵,它們的配位數決定於中心原子成鍵軌道的性質。
配位數
O和NH
等具有小的相互排斥力的弱場配體,生成配位數為 6的【Ni(H
O)
】和【Ni(NH
)
】等八面體配離子;與Br和I等具有大的相互排斥力的弱場配體則趨向於生成配位數為4的【NiBr
】和【NiI
】等正四面體配離子;與CN等強場配體則生成配位數為4的【Ni(CN)
】平面正方形配離子。