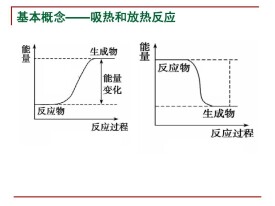
放熱反應
放熱反應
在化學反應中,反應物總能量大於生成物總能量的反應叫做放熱反應。包括燃燒、中和、金屬氧化、鋁熱反應、較活潑的金屬與酸反應、由不穩定物質變為穩定物質的反應。
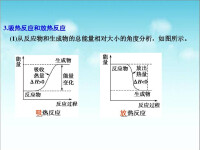
放熱反應
△H=反應物鍵能-生成物鍵能
燃燒、中和、金屬氧化、鋁熱反應、較活潑的金屬與酸反應、由不穩定物質變為穩定物質的反應多數化合反應是放熱的(但是我們要注意高壓下石墨轉變成金剛石也是放熱反應,儘管常壓下是相反的),多數分解反應是吸熱的(但均不能絕對化,如氯酸鉀分解生成氯化鉀與氧氣就是常見的放熱反應)能自發進行的氧化還原反應都是放熱反應,常見反應中燃燒反應、中和反應全是放熱反應,酸鹼中和的反應,金屬與酸的反應,金屬與水的反應,燃燒反應,爆炸反應全是放熱反應,在具體判斷中往往要結合記憶中的事實來進行。放熱反應的逆反應一定是吸熱反應。
(1)所有燃燒或爆炸反應。
(2)酸鹼中和反應。
(3)多數化合反應。
(4)活潑金屬與水或酸生成H2的反應。
(5)很多氧化還原反應(但不能絕對化)。如氫氣、木炭或者一氧化碳還原氧化銅都是典型的放熱反應。
(6)NaOH或濃硫酸溶於水(註:這兩點只是說會放熱,但嚴格說起來並不算化學反應,考試時應注意)
絕大多數的化合反應是放熱反應
1氫化物的生成反應是放熱反應
例如 氫氣與氟氣黑暗處就爆炸放熱:H2 +F2 =2HF
2 氧化物的生成是放熱反應
例如木炭在空氣或氧氣中燃燒放熱:C+O2 = CO2
3含氧酸的生成反應
例如 三氧化硫溶於水生成硫酸是放熱反應:SO3 +H2O=H2SO4
4強鹼的生成反應是放熱反應
例如氧化鈉與水反應生成氫氧化鈉放熱:Na2O+H2O=2NaOH
分解反應少數是放熱反應
例如硝酸銨受熱或受到撞擊爆炸發生分解反應放熱:2NH4NO3 =N2 ↑+O2 ↑ +4H2O
大多數置換反應是放熱反應
1 活潑金屬與水發生置換反應放熱的實例
鈉與水發生置換反應時放熱:2Na+2H2O=2NaOH+H2 ↑
2 活潑非金屬與水發生置換反應放熱的實例
氯氣與水發生岐化反應時放熱:Cl2+H2O=HCl+HClO
3 單質鋁與某些金屬氧化物發生的鋁熱反應放熱的實例
在高溫條件下鋁粉與二氧化錳發生置換反應時放熱:4Al+3MnO 2=2Al2O3 + 3Mn
4活潑金屬與酸發生的置換反應放熱的實例
金屬鈉與鹽酸發生置換反應時放熱:2Na+2HCl=2NaCl+H2 ↑
酸鹼中和反應是放熱反應
鹽酸和氫氧化鈉溶液反應是放熱反應:HCl+NaOH=NaCl+H2O
化學反應的本質是:舊鍵的斷裂和新鍵的形成,而新形成的化學鍵一般比舊鍵要穩定,共價電子從高能級向低能級躍遷,釋放能量,而舊鍵的斷裂則需要吸收能量,所以最終化學反應是吸熱還是放熱看的是反應前後能量變化差值,如果能量不足,則需要從外界吸熱,反之放熱,通常我們用焓變(△H)來衡量反應前後的熱現象.