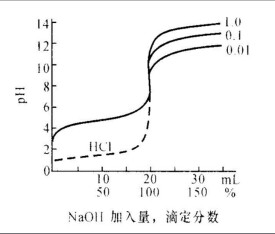
滴定突躍
滴定突躍
分析化學中,在化學計量點前後±0.1%(滴定分析允許誤差)範圍內,溶液參數將發生急劇變化,這種參數(如酸鹼滴定中的pH)的突然改變就是滴定突躍,突躍所在的範圍稱為突躍範圍。突躍的大小受滴定劑濃度(c)和酸(或鹼)的解離常數影響,c越大,突躍越大,解離常數越大,突躍越大。
目錄
滴定突躍的定義:在化學計量點前後加入少量的酸或鹼使溶液的PH值發生突變的現象稱為滴定突躍。
滴定突躍的定義:在化學計量點前後加入少量的酸或鹼使溶液的PH值發生突變的現象稱為滴定突躍。其原因為:pH是質子濃度的負對數,對濃度的數量級很敏感,在中性附近濃度變化很小,引起的pH變化也是很大的。滴定突躍是分析化學滴定分析的重要內容之一。所謂滴定突躍 ,即計量點前後± 0. 1% 誤差範圍內溶液 PH(或 PM)的變化範圍。滴定分析一般藉助指示劑指示終點 ,而滴定突躍是選擇指示劑的依據 ,這正是研究滴定突躍的意義。在教學中滴定突躍一般是通過作圖繪製相應的滴定曲線得到的。如酸鹼滴定中的 PH— V曲線、配位滴定中的 PM— V曲線等。如果對於教材中每一個具體的滴定 ,特別是較為複雜的滴定 ,滴定突躍都通過作圖得到 ,將是很麻煩的。本文意在說明不僅通過作圖 ,而且可以通過簡單的計算得到滴定突躍的方法及在實際教學中應用的意義。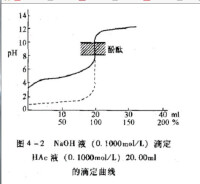

滴定突躍
作圖的方法 ,以滴定為例 ,過程略。見表一和圖一。計算的方法 ,從滴定突躍的概念出發 ,在允許誤差 ( TE% )範圍內 ,以計量點為中心 ,由(酸鹼滴定 )(配位滴定 )所確定的範圍。該範圍即滴定突躍。見圖二。其中。上式是計算滴定突躍的基本公式。公式中的 PHsp或 PMsp是容易計算的 ,問題在於如何計算△ PH或△ PM。 △ PH或△ PM可由終點誤差公式得到。終點誤差公式如下 (推導略 ):
(滴定 )( 滴定一元弱酸 ) ①( 滴定一元弱鹼 B) ( EDTA滴定金屬離子 M)②上述公式中若允許誤差 T E% 已知 (通常給出 ) ,則△ PH或△ PM可求 ,進而滴定突躍可計算。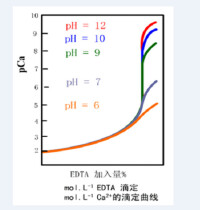

滴定突躍