共找到30條詞條名為分析化學的結果 展開
分析化學
化學分支
徠分析化學是關於研究物質的組成、含量、結構和形態等化學信息的分析方法及理論的一門科學,是化學的一個重要分支。是鑒定物質中含有哪些組分,及物質由什麼組分組成,測定各種組分的相對含量,研究物質的分子結構或晶體。詞條介紹了分析化學的發展歷史、分析方法、應用領域、誤差消除等。

分析化學
分析化學的主要任務是鑒定物質的化學組成(元素、離子、官能團、或化合物)、測定物質的有關組分的含量、確定物質的結構(化學結構、晶體結構、空間分佈)和存在形態(價態、配位態、結晶態)及其與物質性質之間的關係等。
分析化學的任務
(1)確定物質的化學組成——定性分析
(2)測量各組成的含量——定量分析
(3)表徵物質的化學結構、形態、能態——結構分析、形態分析、能態分析
(4)表徵組成、含量、結構、形態、能態的動力學特徵——動態分析
古代的分析化學
火試金法
定性分析和定量分析
容量分析
微量分析
色譜法
薄層層析
熱分析
有機試劑光度分析
原子發射光譜法
電化學分析法
分析方法
分析方法的分類
分析方法的理想條件
分離和富集方法
取樣和試樣分解
第一個重要階段
20世紀二三十年代 利用當時物理化學中的溶液化學平衡理論,動力學理論,如沉澱的生成和共沉澱現象,指示劑作用原理,滴定曲線和終點誤差,催化反應和誘導反應,緩衝作用原理大大地豐富了分析化學的內容,並使分析化學向前邁進了一步.
第二個重要階段
20世紀40年代以後幾十年,第二次世界大戰前後,物理學和電子學的發展,促進了各種儀器分析方法的發展,改變了經典分析化學以化學分析為主的局面。
原子能技術發展,半導體技術的興起,要求分析化學能提供各種靈敏準確而快速的分析方法,如半導體材料,有的要求純度達99.9999999%以上,在新形勢推動下,分析化學達到了迅速發展。
最顯著的特點是各種儀器分析方法和分離技術的廣泛應用。
第三個重要階段
自20世紀70年代以來,以計算機應用為主要標誌的信息時代的到來,促使分析化學進入第三次變革時期。
由於生命科學、環境科學、新材料科學發展的需要,基礎理論及測試手段的完善,現代分析化學完全可能為各種物質提供組成、含量、結構、分佈、形態等等全面的信息,使得微區分析、薄層分析、無損分析、瞬時追蹤、在線監測及過程式控制制等過去的難題都迎刃而解。
分析化學廣泛吸取了當代科學技術的最新成就,成為當代最富活力的學科之一。
對照試驗是檢驗分析過程中有無系統誤差的有效方法。用含量已知的標準試樣或純物質,以同一方法按完全相同的條件,平行測定,由分析結果與已知含量的誤差對結果進行校正,可減免系統誤差。
對於新建立的分析方法,一般要求與經典方法對照,對同一試樣進行測量,比較測量結果的精密度與準確度,以判斷所建方法的可行性。
當無法獲得標準試樣時,分析方法的準確度用回收試驗的結果來衡量。回收試驗是先用所建方法測出試樣中某組分含量,再取幾份相同試樣(n≥5),各加入適量待測組分的純品,按相同條件進行測定
回收率越接近100%,系統誤差越小,方法準確度越高。回收率偏低可能是樣品製備不當、提取不完全或方法本身的系統誤差所致;回收率偏高則可能和方法選擇性差,雜誌干擾等因素有關。回收試驗常在微量組分分析中應用。
空白試驗是採用和測定試樣完全相同的方法、儀器和試劑,但不加入試樣的情況下進行的分析試驗。所得結果成為空白值,從試驗的分析結果中扣除空白值,可消除由試劑、溶劑及試驗器皿等引入的雜質所造成的誤差。
發展簡史
分析化學這一名稱雖創自玻意耳,但其實踐運用與化學工藝的歷史同樣古老。古代冶鍊、釀造等工藝的高度發展,都是與鑒定、分析、製作過程的控制等手段密切聯繫在一起的。在東、西方興起的煉丹術、鍊金術等都可視為分析化學的前驅。
古代化學的發展
公元前3000年,埃及人已經掌握了一些稱量的技術。最早出現的分析用儀器當屬等臂天平,它在公元前1300年的《莎草紙卷》上已有記載。巴比倫的祭司所保管的石制標準砝碼(約公元前2600)尚存於世。不過等臂天平用於化學分析,當始於中世紀的烤缽試金法中。
古代認識的元素,非金屬有碳和硫,金屬中有銅、銀、金、鐵、鉛、錫和汞。公元前四世紀已使用試金石以鑒定金的成色,公元前三世紀,阿基米德在解決敘拉古王喜朗二世的金冕的純度問題時,即利用了金、銀密度之差,這是無傷損分析的先驅。
公元60年左右,老普林尼將五倍子浸液塗在莎草紙上,用以檢出硫酸銅的摻雜物鐵,這是最早使用的有機試劑,也是最早的試紙。遲至1751年,埃勒爾·馮·布羅克豪森用同一方法檢出血渣(經灰化)中的含鐵量。
火試金法是一種古老的分析方法。遠在公元前13世紀,巴比倫王致書埃及法老阿門菲斯四世稱:“陛下送來之金經入爐后,重量減輕……”這說明3000多年前人們已知道“真金不怕火煉”這一事實。法國菲利普六世曾規定黃金檢驗的步驟,其中提出對所使用天平的構造要求和使用方法。
18-19世紀
18世紀的瑞典化學家貝格曼可稱為無機定性、定量分析的奠基人。他最先提出金屬元素除金屬態外,也可以其他形式離析和稱量,特別是水中難溶的形式,這是重量分析中濕法的起源。
德國化學家克拉普羅特不僅改進了重量分析的步驟,還設計了多種非金屬元素測定步驟。他準確地測定了近200種礦物的成分及各種工業產品如玻璃、非鐵合金等的組分。
18世紀分析化學的代表人物首推貝采利烏斯。他引入了一些新試劑和一些新技巧,並使用“無灰濾紙”、“低灰分濾紙”和“洗滌瓶”。他是第一位把原子量測得比較精確的化學家。除無機物外,他還測定過“有機物中元素的百分數”。他對吹管分析尤為重視,即將少許樣品置於“炭塊凹處”,用“氧化”或“還原焰”加熱,以觀察其變化,從而獲得有關樣品的定性知識。此法一直沿用至19世紀,其優點是迅速和所需要的樣品量少,又可用於野外勘探和普查礦產資源等。
19世紀分析化學的傑出人物之一是弗雷澤紐斯,他創立一所分析化學專業學校(此校至今依然存在);並在1862年創辦德文的《分析化學》雜誌,其後人連任主編至今。他編寫的《定性分析》、《定量分析》兩本書編譯為多種文字,包括晚清時代出版的中譯本,定名為《化學考質》和《化學求數》。他將定性分析的“陽離子硫化氫系統”修訂為的五組,還注意到“酸鹼度對金屬硫化物沉澱”的影響。在容量分析中,他提出用二氯化錫滴定三價鐵至黃色消失。
1663年波義耳報道了用植物色素作酸鹼指示劑,這是容量分析的先驅。但真正的容量分析應歸功於法國蓋·呂薩克。1824年他發表“漂白粉中有效氯的測定”,用“磺化靛青”作指示劑。隨後他用硫酸滴定“草木灰”,又用氯化鈉滴定“硝酸銀。”這三項工作分別代表氧化還原滴定法、酸鹼滴定法和沉澱滴定法。絡合滴定法創自李比希,他用銀滴定氰離子。
最早的“微量分析”是“化學顯微術”,即在顯微鏡下觀察樣品或反應物的“晶態”、“光學性質”、“顆粒尺寸”和“圓球直徑”等。17世紀中葉胡克從事顯微鏡術的研究,並於1665年出版《顯微圖譜》。法國藥劑師德卡羅齊耶在1784年用顯微鏡以氯鉑酸鹽形式區別鉀、鈉。德意志化學家馬格拉夫在1747年用顯微鏡證實蔗糖和甜菜糖實為同一物質;在1756年用顯微鏡檢驗鉑族金屬。1891年,萊爾曼提出熱顯微術,即在顯微鏡下觀察晶體遇熱時的變化。科夫勒及其夫人設計了兩種顯微鏡加熱台,便於研究藥物及有機化合物的鑒定。後來又發展到電子顯微鏡,解析度可達1埃。
不用顯微鏡的最早的微量分析者應推德國德貝賴納。他從事“濕法微量分析”,還有吹管法和火焰反應,並發表了《微量化學實驗技術》一書。近代微量分析奠基人是埃米希,他設計和改進微量化學天平,使其靈敏度達到微量化學分析的要求;改進和提出新的操作方法,實現毫克級無機樣品的測定,並證實納克級樣品測定的精確度不亞於毫克級測定。
有機微量定量分析奠基人是普雷格爾,他曾從膽汁中離析出一種降解產物,其量尚不足作一次常量碳氫分析。在聽了埃米希於1909年所作有關微量定量分析的講演並參觀其實驗室后,他決意將常量燃燒法改為微量法(樣品數毫克),並獲得成功;1917年出版《有機微量定量分析》,並在1923年獲諾貝爾化學獎。
德國化學家龍格在1850年將染料混合液滴在吸墨紙上使之分離,更早些時候他曾用染有澱粉和碘化鉀溶液的濾紙或花布塊作過漂白液的點滴試驗。他又用浸過硫酸鐵和銅溶液的紙,在其中部滴加“黃血鹽”,等每滴吸入后再加第二滴,因此獲得自行產生的美麗圖案。1861年出現舍恩拜因的毛細管分析,他將濾紙條浸入“含數種無機鹽”的水中,水攜帶“鹽類”沿紙條上升,以水升得最高,其他離子依其遷移率而分離成為連接的帶。這與紙層析極為相近。他的學生研究於濾紙上分離有機化合物獲得成功,能明顯而完全分離有機染料。
20世紀60年代,魏斯提出環爐技術。僅用微克量樣品置濾紙中,繼用溶劑淋洗,而後在濾紙外沿加熱以蒸發溶劑,遂分離為若干同心環。如離子無色可噴以靈敏的顯色劑或熒光劑,既能檢出,又能得半定量結果。
發展概述
火試金法是久經考驗的一種分析方法。遠在公元前13世紀,巴比倫王致書埃及法老阿門菲斯四世稱:“陛下送來之金經入爐后,重量減輕……。”這說明3000多年前人們已知道“真金不怕火煉”這一事實。14世紀時,在歐洲已用法律規定烤缽試金法為檢驗黃金的手段。匈牙利王查理一世曾令每一礦城須建立一個火試金試驗室。法國國王菲利普六世曾規定黃金檢驗的步驟,其中並提出對所使用天平的構造要求和使用方法,如天平不應置於受風吹或寒冷之處,使用者的呼吸不得影響天平的稱量等。
1540年出版的《火技藝》一書已詳述用骨灰製作烤缽和灰吹法。隨後不久,火試金法即推廣至某些賤金屬,特別是銅和鉛礦石分析。德意志G.阿格里科拉在其名著《坤輿格致》第七章中,系統敘述火試金法。本法又稱干法,適用於能從樣品中以粒狀或鈕扣狀析出的金屬,而不適用於非金屬。
定性分析和定量分析 瑞典化學家T.O.貝格曼可稱為無機定性、定量分析的奠基人。他首先提出金屬元素除金屬態外,也可以其他形式離析和稱量,特別是以水中難溶的形式,這是重量分析中濕法的起源。當時還沒有原子量,也沒有化合物的分子式。他的換算因子是由實驗直接獲得的。
德意志化學家M.H.克拉普羅特不僅改進了重量分析的步驟,還設計了多種非金屬元素測定步驟。他準確地測定了近200種礦物的成分及各種工業產品如玻璃、非鐵合金等的組分。
18世紀分析化學的代表人物首推J.J.貝采利烏斯。他引入了一些新試劑(如氫氟酸用於分解硅酸鹽岩石和二氧化硅測定)和一些新技巧,並使用無灰濾紙、低灰分濾紙和洗滌瓶。他是第一位把原子量測得比較精確的化學家。除無機物外,他還測定過有機物中元素的百分數。他對吹管分析尤為重視。吹管分析可認為是冶金操作之微型化,即將少許樣品置於炭塊凹處,用氧化或還原焰加熱,以觀察其變化,從而獲得有關樣品的定性知識。此法沿用至19世紀,其優點是迅速、所需樣品量少,又可用於野外勘探和普查礦產資源等。
19世紀分析化學的傑出人物之一是C.R.弗雷澤紐斯,他創立一所分析化學專業學校,至今此校仍存在;並於1862年創辦德文的《分析化學》雜誌,由其後人繼續任主編至今。他編寫的《定性分析》、《定量分析》兩書曾譯為多種文字,包括晚清時代出版的中譯本,分別定名為《化學考質》和《化學求數》。他將定性分析的陽離子硫化氫系統修訂為五組,還注意到酸鹼度對金屬硫化物沉澱的影響。在容量分析中,他提出用二氯化錫滴定三價鐵至黃色消失。
分析化學主要任務是研究下列問題:①物質中有哪些元素和(或)基團(定性分析);②每種成 分的數量或物質純度如何(定量分析);③物質中原子彼此如何聯結而成分子和在空間如何排列(結構和立體分析)。研究對象從單質到複雜的混合物和大分子化合物,從無機物到有機物,從低分子量到高分子量(如10原子質量單位)。樣品可以是氣態、液態和固態。稱樣重量可由 100克以上以至毫克以下。1931年E.威森伯格提出的殘渣測定,只取10微克樣品,便屬於超微量分析。所用儀器從試管直到高級儀器(附自動化設備並用電子計算機程序控制、記錄和儲存)。分析化學以化學基本理論和實驗技術為基礎,並吸收物理、生物、統計、電子計算機、自動化等方面的知識以充實本身的內容,從而解決科學、技術所提出的各種分析問題。
當代分析化學將研究分為兩個範疇,一是分析的對象,一是分析的方法。<分析化學期刊>(Analytical Chemistry)每年在第12期會在兩個範疇輪流做一次回顧評述。
分析的對象
生物分析化學(Bioanalytical chemistry)
材料分析(Material analysis)
化學分析(Chemical analysis)
環境分析(Environmental analysis)
分析的方法
光譜學
質譜學
分光度和比色法
層析和電泳法
結晶學
顯微術
電化學分析
古典分析
雖說當代分析方法絕大部分為儀器分析,但有些儀器最初的設計目的,是為了簡化古典方法的不便,基本原理仍來自於古典分析。另外,樣品配置等前置處理,仍需要藉由古典分析手法的協助。以下舉一些古典分析方法:滴定法
重量分析
無機定性分析
儀器分析
原子吸收光譜法(Atomic absorption spectroscopy, AAS)
原子熒光光譜法(Atomic fluorescence spectroscopy, AFS)
α質子-X射線光譜儀(Alpha particle X-ray spectrometer, APXS)
毛細管電泳分析儀(Capillary electrophoresis, CE)
色譜法(Chromatography)
比色法(Colorimetry)
循環伏安法(Cyclic Voltammetry, CV)
差示掃描量熱法(Differential scanning calorimetry, DSC)
電子順旋共振儀(Electron paramagnetic resonance, EPR)
電子自旋共振(Electron spin resonance, ESR)
橢圓偏振技術(Ellipsometry)
場流分離法(Field flow fractionation, FFF)
傳式轉換紅外線光譜術(Fourier Transform Infrared Spectroscopy, FTIR)
氣相色譜法(Gas chromatography, GC)
氣相色譜-質譜法(Gas chromatography-mass spectrometry, GC-MS)
高效液相色譜法(High Performance Liquid Chromatography, HPLC)
離子微探針(Ion Microprobe, IM)
感應耦合電漿(Inductively coupled plasma, ICP)
Instrumental mass fractionation (IMF)
選擇性電極(Ion selective electrode, ISE)
激光誘導擊穿光譜儀(Laser Induced Breakdown Spectroscopy, LIBS)
質譜儀(Mass spectrometry, MS)
穆斯堡爾光譜儀系統(Mossbauer spectroscopy)
核磁共振(Nuclear magnetic resonance, NMR)
粒子誘發X-射線產生(Particle induced X-ray emission spectroscopy,PIXE)
熱裂解-氣相色譜-質譜儀(Pyrolysis-Gas Chromatography-Mass Spectrometry, PY-GC-MS)
拉曼光譜(Raman spectroscopy)
折射率
共振增強多光子電離譜(Resonance enhanced multi-photon ionization, REMPI)
掃瞄穿透X射線顯微鏡(Scanning transmission X-ray microscopy, STXM)
薄板層析(Thin layer chromatography, TLC)
穿透式電子顯微鏡(Transmission electron microscopy, TEM)
X射線熒光光譜儀(X-ray fluorescence spectroscopy, XRF)
X射線顯微鏡(X-ray microscopy, XRM)
分析化學這一名稱雖創自R.玻意耳,但其實踐應與化學工藝同樣古老。不能想象古代冶鍊、釀造等工藝的高度發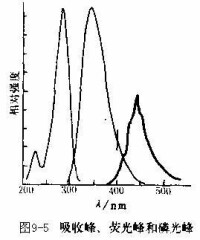 展,沒有簡單的鑒定、分析、製作過程的控制等手段。隨後在東、西方興起的煉丹術、鍊金術可視為分析化學的前驅。
展,沒有簡單的鑒定、分析、製作過程的控制等手段。隨後在東、西方興起的煉丹術、鍊金術可視為分析化學的前驅。

分析化學
古代的分析化學公元前3000年,埃及人已知稱量的技術。最早出現的分析用儀器當推等臂天平,它記載在《莎草紙卷》(公元前1300)上。巴比倫的祭司所保管的石制標準砝碼(約公元前2600)尚存於世。不過等臂天平用於分析,當在中世紀用於烤缽試金法(火試金法之一)中。
古代認識的元素,非金屬有碳和硫,金屬中有銅、銀、金、鐵、鉛、錫和汞。公元前4世紀已知使用試金石以鑒定金的成色。公元前3世紀,阿基米德在解決敘拉古王喜朗二世的金冕的純度問題時,即利用了金、銀密度之差。這是無傷損分析之先驅。
公元60年左右,老普林尼將五倍子浸液塗在莎草紙上,用以檢出硫酸銅的摻雜物鐵(Ⅲ),這是最早使用的有機試劑,也是最早的試紙。遲至1751年,J.T.埃勒爾·馮·布羅克豪森用同一方法檢出血渣(經灰化)中的含鐵量。
分析化學是研究物質組成的科學,它包括化學分析、儀器分析兩部分。
化學分析包括滴定分析和稱量分析,它是根據物質的化學性質來測定物質的組成及相對含量。
儀器分析的方法很多,它是根據物質的物理性質或物質的物理化學性質來測定物質的組成及相對含量。儀器分析根據測定的方法原理不同,可分為電化學分析、光學分析、色譜分析、其他分析法等4大類。如右圖。
化學分析是基礎,儀器分析是目前的發展方向。
火試金法是久經考驗的一種分析方法。遠在公元前13世紀,巴比倫王致書埃及法老阿門菲斯四世稱:“陛下送來之金經入爐后,重量減輕……。”這說明3000多年前人們已知道“真金不怕火煉”這一事實。14世紀時,在歐洲已用法律規定烤缽試金法為檢驗黃金的手段。匈牙利王查理一世曾令每一礦城須建立一個火試金試驗室。法國國王菲利普六世曾規定黃金檢驗的步驟,其中並提出對所使用天平的構造要求和使用方法,如天平不應置於受風吹或寒冷之處,使用者的呼吸不得影響天平的稱量等。
1540年出版的《火技藝》一書已詳述用骨灰製作烤缽和灰吹法。隨後不久,火試金法即推廣至某些賤金屬,特別是銅和鉛礦石分析。德意志G.阿格里科拉在其名著《坤輿格致》第七章中,系統敘述火試金法。本法又稱干法,適用於能從樣品中以粒狀或鈕扣狀析出的金屬,而不適用於非金屬。
定性分析和定量分析瑞典化學家T.O.貝格曼可稱為無機定性、定量分析的奠基人。他首先提出金屬元素除金屬態外,也可以其他形式離析和稱量,特別是以水中難溶的形式,這是重量分析中濕法的起源。當時還沒有原子量,也沒有化合物的分子式。他的換算因子是由實驗直接獲得的。
德意志化學家M.H.克拉普羅特不僅改進了重量分析的步驟,還設計了多種非金屬元素測定步驟。他準確地測定了近200種礦物的成分及各種工業產品如玻璃、非鐵合金等的組分。
18世紀分析化學的代表人物首推J.J.貝采利烏斯。他引入了一些新試劑(如氫氟酸用於分解硅酸鹽岩石和二氧化硅測定)和一些新技巧,並使用無灰濾紙、低灰分濾紙和洗滌瓶。他是第一位把原子量測得比較精確的化學家。除無機物外,他還測定過有機物中元素的百分數。他對吹管分析尤為重視。吹管分析可認為是冶金操作之微型化,即將少許樣品置於炭塊凹處,用氧化或還原焰加熱,以觀察其變化,從而獲得有關樣品的定性知識。此法沿用至19世紀,其優點是迅速、所需樣品量少,又可用於野外勘探和普查礦產資源等。
19世紀分析化學的傑出人物之一是C.R.弗雷澤紐斯,他創立一所分析化學專業學校,至今此校仍存在;並於1862年創辦德文的《分析化學》雜誌,由其後人繼續任主編至今。他編寫的《定性分析》、《定量分析》兩書曾譯為多種文字,包括晚清時代出版的中譯本,分別定名為《化學考質》和《化學求數》。他將定性分析的陽離子硫化氫系統修訂為目前的五組,還注意到酸鹼度對金屬硫化物沉澱的影響。在容量分析中,他提出用二氯化錫滴定三價鐵至黃色消失。
容量分析1663年玻意耳報道了用植物色素作酸鹼指示劑。但真正的容量分析應歸功於法國J.-L.蓋-呂薩克。1824年他發表漂白粉中有效氯的測定,用磺化靛青作指示劑。隨後他用硫酸滴定草木灰,又用氯化鈉滴定硝酸銀。這三項工作分別代表氧化還原滴定法、酸鹼滴定法和沉澱滴定法。絡合滴定法創自J.von李比希,他用銀(Ⅰ)滴定氰離子。
另一位對容量分析作出卓越貢獻的是德國K.F.莫爾,他設計的可盛強鹼溶液的滴定管至今仍在沿用。他推薦草酸作鹼量法的基準物質,硫酸亞鐵銨(也稱莫爾鹽)作氧化還原滴定法的基準物質。
微量分析最早的微量分析是化學顯微術,即在顯微鏡下觀察樣品或反應物的晶態、光學性質、顆粒尺寸和圓球直徑等。17世紀中葉R.胡克從事顯微鏡術的研究,並於1665年出版《顯微圖譜》。法國藥劑師F.A.H.德卡羅齊耶在1784年用顯微鏡以氯鉑酸鹽形式區別鉀、鈉。德意志化學家A.S.馬格拉夫在1747年用顯微鏡證實蔗糖和甜菜糖實為同一物質;在1756年用顯微鏡檢驗鉑族金屬。1865年A.黑爾維希著《毒物學中之顯微鏡》。1877年S.A.博里基著《以化學/顯微鏡法作礦物與岩石分析》,並使用氣體試劑(如氟化氫、氯)、氟硅酸和硫化銨與礦物及其切片作用。T.H.貝侖斯不僅從事無機物的晶體檢驗,還擴充到有機晶體。1891年O.萊爾曼提出熱顯微術,即在顯微鏡下觀察晶體遇熱時的變化。L.科夫勒及其夫人設計了兩種顯微鏡加熱台,便於研究藥物及有機化合物的鑒定。熱顯微術只需一粒晶體。後來又發展到電子顯微鏡,解析度可達1埃。
不用顯微鏡的最早的微量分析者應推德國J.W.德貝賴納。他從事濕法微量分析,還有吹管法和火焰反應,並發表了《微量化學實驗技術》一書。公認的近代微量分析奠基人是F.埃米希。他設計和改進微量化學天平,使其靈敏度達到微量化學分析的要求,改進和提出新的操作方法,實現毫克級無機樣品的測定,並證實納克級樣品測定的精確度不亞於毫克級測定。有機微量定量分析奠基人是F.普雷格爾,他曾從膽汁中離析一降解產物,其量尚不足作一次常量碳氫分析,在聽了埃米希於1909年所作的有關微量定量分析的講演並參觀其實驗室后,他決意將常量燃燒法改為微量法(樣品數毫克),並獲得成功;1917年出版《有機微量定量分析》一書,並在1923年獲諾貝爾化學獎。
常量操作如不適用於微量分析則需改進。例如,常量過濾是將沉澱定量移入濾紙錐中或過濾坩堝中。若用此法於微量沉澱過濾,則在原進行沉澱的燒杯壁所粘附的物質就不能再忽略不計了,所以必須改變辦法。微量過濾採用濾棒吸出母液,而留全部沉澱於容器中。容器可用25毫升瓷坩堝,它兼用作稱量器皿;還可在其內洗滌沉澱,然後再用濾棒吸出洗液。這樣既可避免沉澱損失,又可簡化操作手續。
無機化合物在濾紙上的行為在19世紀中已引起注意。德意志化學家F.F.龍格在1850年將染料混合液滴在吸墨紙上使之分離。更早些時候他用染有澱粉和碘化鉀溶液的濾紙或花布塊作漂白液的點滴試驗。他又用浸過硫酸鐵(Ⅲ)和銅(Ⅱ)溶液的紙,在其中部滴加黃血鹽,等每滴吸入后再加第二滴,因此獲得自行產生的美麗圖案。1861年出現C.F.舍恩拜因的毛細管分析,他將濾紙條浸入含數種無機鹽的水中,水攜帶鹽類沿紙條上升,以水升得最高,其他離子依其遷移率而分離成為連接的帶。這與紙層析極為相近。他的學生研究於濾紙上分離有機化合物獲得成功,能明顯而完全分離有機染料。
用濾紙或瓷板進行無機、有機物的檢出是普雷格爾的貢獻。方法簡單而易行,選擇性和靈敏度均高,點滴試驗屬微量分析範圍。所著《點滴試驗》和《專一、選擇和靈敏反應的化學》兩書,為從事分析者所必讀。1921年後奧地利F.法伊格爾系統地發展了點滴試驗法。
20世紀60年代,H.魏斯提出環爐技術。僅用微克量樣品置濾紙中心,繼用溶劑淋洗,而在濾紙外沿加熱以蒸發溶劑,遂分離為若干同心環。如離子無色可噴以靈敏的顯色劑或熒光劑。既能檢出,又能得半定量結果。
色譜法也稱層析法,基本上是分離方法。1906年俄國М.С.茨維特將綠葉提取汁加在碳酸鈣沉澱柱頂部,繼用純溶劑淋洗,從而分離了葉綠素。此項研究發表在德國《植物學》雜誌上,故未能引起人們注意。直至1931年德國R.庫恩和E.萊德爾再次發現本法並顯示其效能,人們才從文獻中追溯到茨維特的研究和更早的有關研究,如1850年J.T.韋曾利用土壤柱進行分離;1893年L.里德用高嶺土柱分離無機鹽和有機鹽。四年後D.T.戴用漂白土分離石油。
氣體吸附層析始於20世紀30年代的P.舒夫坦和A.尤肯。40年代,德國Y.黑塞利用氣體吸附以分離揮發性有機酸。英國E.格盧考夫也用同一原理在1946年分離空氣中的氦和氖,並在1951年製成氣相色譜儀(見氣相色譜法)。第一台現代氣相色譜儀研製成功應歸功於E.克里默。
氣體分配層析法根據液液分配原理,由英國A.J.P.馬丁和R.L.M.辛格於1941年提出。由於此工作之重要,他們獲得1952年諾貝爾化學獎。M.J.E.戈萊提出用長毛細管柱,是另一創新。
色譜-質譜聯用法中將色譜法所得之淋出流體移入質譜儀,可使複雜的有機混合物在數小時內得到分離和鑒定,是最有效的分析方法之一。
液相色譜法包括液-液和液-固色譜,后兩個名稱之第一物態代表流動相,第二物態代表固定相。在大氣壓力下,液相色譜流速太低,因此須增加壓強。這方面的先驅工作是P.B.哈密頓在1960年用高壓液相色譜分離氨基酸。1963年J.C.吉丁斯指出,液相色譜法的柱效要趕上氣相色譜法,則前者填充物顆粒應小於後者顆粒甚多,因此需要大壓強,所用的泵應無脈衝。1966年R.詹特福特和T.H.高製成這種無脈衝泵。1969年J.J.柯克蘭改進填充物,使之具有規定的表面孔度,再將固定相(如正十六烷基)鍵合在載體上,使之能抗熱和抗溶劑分解。載體可用二氧化硅,鍵合通過Si-O-C或Si-C鍵。
薄層層析採用薄層硅膠等代替濾紙進行層析。由於硅膠顆粒均勻而細微,分離的速度和程度一般優於紙層析,分離無機物和有機物時與紙層析一樣有效。荷蘭生物學家M.W.拜爾因克在1889年滴一滴鹽酸和硫酸的混合液於動物膠薄層中部,鹽酸擴散遠些,在硫酸環之外另成一環,相繼用硝酸銀和氯化鋇顯示這兩個環的存在。9年後H.P.維伊斯曼用同樣方法證明麥芽的澱粉酶中實含兩種酶。直至1956年聯邦德國E.施塔爾改善塗布方法和操作,採用細顆粒(0.5~5微米)硅膠等措施,才使該法得到廣泛使用。定量薄層層析始於J.G.基施納等(1954)。他們最先測定橙柑屬及其加工品中的聯苯(見薄層層析)。
熱分析希臘哲學家泰奧弗拉斯圖斯曾記錄各種岩石礦物及其他物質遇熱所發生的影響。法國H.-L.勒夏忒列和英國W.C.羅伯茨-奧斯汀同稱為差熱分析的鼻祖。20世紀60年代出現精細的差熱分析儀和M.J.奧尼爾提出的差示掃描量熱法,它能測定化合物的純度及其他參數,如熔點和玻璃化、聚合、熱降解、氧化等溫度(見熱分析)。
20世紀初提出的熱重量法是研究物質,如鋼鐵、沉澱等遇熱時重量之變化。本多光太郎創製第一架熱天平,它最初只用於解決冶金方面的問題。將它用於分析方面的當推C.杜瓦爾。他曾研究過1000多種沉澱的熱行為。例如草酸鈣用高溫可灼燒為氧化鈣,也可在約550°C灼燒為碳酸鈣。二者作為稱量形式,則以後者為佳,因灼燒時既省能量,換算因子值較大(因此誤差較小),又免氧化鈣在稱量時吸潮。
電解時,銅(Ⅱ)在陰極還原而以單質(零價)析出,再進行稱量,應歸入重量法。此時可認為電子是沉澱劑。還有鉛(Ⅱ)在陽極氧化,以二氧化鉛形式附於陽極。前法在19世紀60年代分別由德意志C.盧科和美國J.W.吉布斯獨立提出。
有機試劑 19世紀初,用於無機重量分析的有機試劑只有草酸及其銨鹽和琥珀酸銨兩種。前者用於鈣、鎂分離和鈣的測定。後者用於沉澱三價鐵使它與二價金屬離子分離。1885年M.A.伊林斯基和G.von克諾雷提出1-亞硝基-2-萘酚作為鎳存在時鈷的沉澱劑,同時也是第一個螯合劑。至於陰離子測定,在20世紀初,W.米勒提出4,4-聯苯胺作為硫酸根的沉澱劑。1950年中國梁樹權等將有機試劑用於重量分析,測定鎢酸根。1950年M.布希引入4,5-二氫-1,4-二苯基-3,5-苯亞氨基-1,2,4-三氮雜茂(簡稱硝酸根試劑)作為硝酸根沉澱劑。1975年後,它又成為高錸酸根的良好沉澱劑。1950年Л.A.楚加耶夫合成了丁二肟,並觀察到它與鎳(Ⅱ)形成紅色沉澱。兩年後,聯邦德國O.E.布龍克把丁二肟試劑應用於鋼中鎳的測定。嗣後靈敏的和選擇性高的新有機試劑不斷出現。中國曾雲鶚等合成3-(2-胂酸基苯偶氮)-6-(2,6-二溴-4-氯苯偶氮)-4,5-二羥基-2,7-萘二磺酸,用此試劑時,稀土元素的摩爾吸光係數可以高達0.98~1.2×10升/(摩·厘米)。
光度分析比色法以日光為光源,靠目視比較顏色深淺。最早的記錄是1838年W.A.蘭帕迪烏斯在玻璃量筒中測定鈷礦中的鐵和鎳,用標準參比溶液與試樣溶液相比較。1846年A.雅克蘭提出根據銅氨溶液的藍色測定銅。隨後有T.J.赫羅帕思的硫氰酸根法測定鐵(1852);奈斯勒法測定氨;苯酚二磺酸法測定硝酸根(1864);過氧化氫法測定鈦(1870);亞甲基藍法測定硫化氫(1883);磷硅酸法測定二氧化硅(1898)。分光光度計使用單色光和光電倍增管,波長範圍為220~1000納米,比目視範圍(400~700納米)更寬。
用光照射懸浮液,從頂部觀察,當視線與光線成直角時,稱為比霧法;如果視線與光線在一條直線上時,稱為比濁法。18世紀50年代G.J.馬爾德在原子量測定中,利用了目測上層液體中氯化銀懸浮液的亮度。隨後,J.-S.斯塔改用一標準懸浮液作參比。1894年美國T.W.理查茲設計出第一台比霧計。比霧法最初用於觀測原子量測定中母液中的氯(或溴)離子和銀離子濃度是否達到當量。隨後此法用於定量測定,其靈敏度很高,可測定一升水所含的3微克磷,或一升水所含的10微克丙酮。
最早研究化合物的紫外吸收光譜的是V.亨利(1914),他繪製出摩爾吸光係數對波長的曲線。紅外光譜在20年代開始應用於汽油爆震研究,繼用於鑒定天然和合成橡膠以及其他有機化合物中的未知物和雜質。喇曼光譜(見喇曼光譜學是研究分子振動的另一種方法。喇曼光譜法的信號太弱,使用困難,直至用激光作為單色光源后,才促進其在分析化學中的應用。遠紅外光譜(200~10厘米)和微波譜(10~0.1厘米)是研究分子旋轉的光譜法。
原子發射光譜法可上溯至I.牛頓,他在暗室中用稜鏡分日光為七色(1672)。1800年F.W.赫歇耳發現紅外線。次年J.W.里特用氯化銀還原現象發現紫外區。又次年W.H.渥拉斯頓觀察到日光光譜的暗線。15年後J.von夫琅和費經過研究,命名暗線為夫琅和費線。現在文獻中稱鈉線為D線,也是夫琅和費規定的。R.W.本生髮明了名為本生燈的煤氣燈,燈的火焰近於透明而不發光,便於光譜研究。1859年本生和他的同事物理學家G.R.基爾霍夫研究各元素在火焰中呈示的特徵發射和吸收光譜,並指出日光光譜中的夫琅和費線是原子吸收線,因為太陽的大氣中存在各種元素。他們用的儀器已具備現代分光鏡的要素。他們可稱為發射光譜法的創始人。
電化學分析法W.H.能斯脫在1889年提出了能斯脫公式,將電動勢與離子濃度、溫度聯繫起來,奠定了電化學的理論基礎。隨後,電化學分析法有了發展,電沉積重量法、電位分析法、電導分析法、安培滴定法、庫侖滴定法、示波極譜法相繼出現。氫電極、玻璃電極和離子選擇性電極陸續製成。尤以極譜分析技術貢獻卓著。
分析方法分析方法的分類 ①按方法的原理可分:化學分析和儀器分析。凡主要利用化學原理進行分析的方法稱為化學分析法;而主要利用物理學原理進行分析的方法則稱為儀器分析法。當然這兩者的界限難以截然劃清,也有介乎二者之間的方法。儀器一般指大型儀器,如核磁共振儀(見核磁共振譜)、X射線熒光儀(見X射線熒光光譜分析法)、X射線衍射儀、質譜儀(見質譜法)、電子能譜儀等。原子發射光譜法和原子吸收光譜法基本上採用濕法預處理,然後在相應儀器中測定,可認為是介於二者之間的方法,也可看作是化學法與儀器法的聯合使用。不能認為用到儀器就是儀器分析。例如,重量分析開始於用天平稱量樣品,末一步再用天平稱沉澱重量。天平是物理儀器,稱量是物理過程,但重量分析卻是公認的典型化學分析法,原因是重量分析主要靠欲測離子與沉澱劑作用而定量析出沉澱。至於經典法一詞,專指重量分析法和容量分析。其範圍遠狹於化學法。所以經典法僅是化學分析法的一部分,而不是全部。②按樣品性質可粗分為無機分析和有機分析兩大類。天然產物和工業製品中的無機物,如岩石、礦物、陶瓷、鋼鐵、合金、礦物酸、燒鹼等的分析屬無機分析;石油、染料、塑料、食品、合成藥物、中草藥等的分析屬有機分析。簡言之,凡碳氫化合物及其衍生物的分析屬有機分析,而除上述物質外的分析統屬無機分析。不過,無機物中有時夾雜一些有機物質,而有機物也含有無機物質。例如,河水、海水中含有有機物,有些錳礦夾雜有機物,煤含有灰分,石油含有以絡合物形式存在的金屬,紙張中有無機填充物等。這類物品既用到無機分析,也用到有機分析。
還有一些方法對無機物質和有機物質同樣有效,如氣相色譜法便是其中之一。樣品中一氧化碳、二氧化碳、氫、氮、氧、甲烷、乙烯、水氣等在同一柱中,在選擇的條件下可逐一分離或分組分離。奧薩特氣體分析器也是如此,只是分離的原理不同。
痕量分析是指樣品所含的量極為微少。一般,在樣品中含量多的為主要成分,含量少的為次要成分。E.B.桑德爾認為含量在1%~0.01%的為次要成分。有人認為在10%~0.01%的為次要成分。含量在萬分之一(0.01%)以下稱為痕量。痕量分析的動向趨於測定愈來愈低的含量,因此出現了超痕量分析,即含量接近或低於一般痕量下限。這名稱只是定性的。定量或更明確的名稱見下列規定:
痕量10~10微克/克
微痕量10~10微克/克
納痕量10~10微克/克
沙痕量10~10
微克/克微痕量分析尚另有一種意義,即使用微量分析的稱樣,而測定其中痕量元素(例如<10微克/克)。為與前述一詞區分,后一詞應稱為微樣痕量分析。
分析方法的理想條件①選擇性最高,以至具有專一性,即干擾極少,這樣就可以減輕或省略分離步驟;②精密度和準確度最高;③靈敏度最高,從而少量或痕量組分即可檢定和測定;④測定範圍最廣,大量和痕量均能測定;⑤能測定的元素種類和物種最多;⑥方法簡便,即最易操作而不需高度技巧;⑦經濟實惠,即要求費用少而收益大。但彙集所有優點於一法是辦不到的,例如,在重量分析中,如要提高準確度,需要延長分析時間(如用重沉澱法純化沉澱)。因為化學法測定原子量要求準確到十萬分之一,所以最費時間。
分析方法要力求簡便,不僅野外工作(諸如地質普查、化學探礦、環境監測、土壤檢測等)需要簡便、有效的化學分析方法,室內例行分析工作也如此。因為在不損失所要求之準確度和精度的前提下,簡便方法步驟少,這就意味著節省時間、人力和費用。例如,金店收購金首飾時,是將其在試金石板上劃一道(科學名稱是條紋),然後從條紋的顏色來決定金的成色。這種條紋法在礦物鑒定中仍然採用。當然,該法不及火試金法或原子吸收光譜法準確,但已能達到鑒定金器之目的。又如,糖尿病人的尿糖量可用特製的含酶試紙進行檢驗,從試紙的顏色變化估計含糖量的多寡,其方法之簡便連患者本人也會使用。另一方面,用原子吸收光譜法雖然也能間接測定尿中含糖量,但因為不經濟而沒有被採用。
分離和富集方法雖然有不少靈敏的和選擇性強(甚至專一)的方法,但是如果欲測元素的濃度接近或低於方法的測定下限,則富集仍不可避免。富集方法很多,如升華、揮發、蒸餾、泡沫浮選(見痕量富集)、吸附(用分子篩、活性炭等)、色譜法、共沉澱、共結晶、汞齊作用、選擇溶解、溶劑萃取、離子交換等。
在檢出或測定之前,常常需要使欲測(或檢出)物質與干擾物質彼此分離。重要的分離方法有蒸餾、溶劑萃取、離子交換、電滲析、沉澱、電泳等,大都與富集方法相同。富集可認為是提高濃度的分離方法。
隱蔽作用(見隱蔽和解蔽)雖不是分離,但其作用使離子失去其正常性質,即令該離子以另一形式存於反應體系中。然而在分析化學中分離之目的無非使干擾離子不再干擾,因此就廣義而言,隱蔽及其相反作用解蔽應包括在分離範疇中。在分析化學中採用隱蔽和解蔽作用由來已久。重量分析、光度法、極譜法中均已應用,特別在點滴試驗和絡合滴定法中使用得更頻繁。
取樣和試樣分解取樣最重要的要求是有代表性,即取來欲分析的樣品須能代表全體。均勻或容易混勻的物質取樣自不成問題,氣態和液態樣品屬於這一類。不均勻的固態物質,如礦石和煤炭等應按規定手續取樣。否則,分析結果不能代表原物質,徒然浪費人力物力。野外礦石取樣多由地質人員進行。所得大樣在試驗室中由分析人員按一定手續粉碎和縮分到小樣。另一方面,有機元素燃燒法分析合成的純樣品則無此問題。
樣品溶熔是第二步。溶熔包括溶解和熔融,也稱分解。有些樣品能溶解於水、酸或混合酸、鹼,以及有機溶劑中。上述辦法不能溶解的,可改用熔劑熔融。熔劑可分鹼性(如碳酸鈉)、酸性(如硫酸氫鉀)、氧化性(如過氧化鈉)和還原性的(如硫代硫酸鈉)。如果欲分析的成分較易揮發或熔融溫度高,對坩堝腐蝕嚴重,則可改用燒結,即將顆粒表面部分熔化。史密斯法用氯化銨和碳酸鈣(1:8~12)與硅酸鹽岩石混合和燒結,以測定其中的鹼金屬便是一例。有機化合物和生物樣品可採用干法或濕法灰化。干法灰化為在充分氧氣存在下加熱至炭化並逐漸燃燒,或在較低溫度用原子氧氧化(低溫灰化)。濕法灰化利用氧化性酸(如硝酸、高氯酸、濃硫酸)氧化樣品。干法、濕法各有其優缺點,須視樣品而定。
當代分析化學著重儀器分析,常用的分析儀器有幾大類,包括原子與分子光譜儀,電化學分析儀器,核磁共振,X光,以及質譜儀。儀器分析之外的分析化學方法,現在統稱為古典分析化學。
分析化學是化學的一個重要分支,它主要研究物質中有哪些元素或基團(定性分析);每種成分的數量或物質純度如何(定量分析);原子如何聯結成分子,以及在空間如何排列等等。
分析化學有極高的實用價值,對人類的物質文明做出了重要貢獻,廣泛的應用於地質普查、礦產勘探、冶金、化學工業、能源、農業、醫藥、臨床化驗、環境保護、商品檢驗、考古分析、法醫刑偵鑒定等領域。
分析化學所用的手段可分為化學分析法和儀器分析法。二者各有優缺點,唇齒相依,相輔相成。分析化學者必須明瞭每一種方法的原理及其應用範圍和優缺點,這樣在解決分析問題時才能得心應手,選擇最適宜的方法。一般來說,化學法準確、精密、費用少而且容易掌握。儀器法迅速,能處理大批樣品,但大型儀器價格昂貴,幾年後又須更新儀器。二者均將得到發展和提高。
近來分析化學中的新技術有激光在分析化學中的應用、流動注射法、場流分級等。場流分級所用的場可以是重力、磁、電、熱等,樣品流經適當的場時能進行分級,故稱為場流分級。目前,該法已成功地用於有機大分子(如血球、高聚物等)之分級。可以預期它在無機物分離方面也將得到應用。
加強對高靈敏度和高選擇性試劑的研究,對於隱蔽、解蔽和分離、富集方法的研究,以及元素存在狀態的測定(與環境分析和地球化學的關係至為密切)都是重要的課題。將二三種各具優點的方法聯合使用,可使以前不能測定的項目變為可能,仍是發展的方向,氣相色譜法與質譜法的聯用便是明顯的例子。
分析化學有極高的實用價值,對人類的物質文明作出了重要貢獻,廣泛用於地質普查、礦產勘探、冶金、化學工業、能源、農業、醫藥、臨床化驗、環境保護、商品檢驗等領域。
古代人認識的元素,非金屬元素有碳和硫,金屬元素中有銅、銀、金、鐵、鉛、錫和汞。
分析化學這一名稱雖創自R.玻意耳,但其實踐應與化學工藝同樣古老。不能想象古代冶鍊、釀造等工藝的高度發展,沒有簡單的鑒定、分析、製作過程的控制等手段。隨後在東、西方興起的煉丹術、鍊金術可視為分析化學的前驅。
公元前3000年,埃及人已知稱量的技術。最早出現的分析用儀器當推等臂天平,它記載在《莎草紙卷》(公元前1300)上。巴比倫的祭司所保管的石制標準砝碼(約公元前2600)尚存於世。不過等臂天平用於分析,當在中世紀用於烤缽試金法(火試金法之一)中。
公元前4世紀,已知使用試金石以鑒定金的成色。
公元前3世紀,阿基米德在解決敘拉古王喜朗二世的金冕的純度問題時,即利用了金和銀密度之差,這是無傷損分析之先驅。
公元60年左右,老普林尼將五倍子浸液塗在莎草紙上,用以檢出硫酸銅的摻雜物鐵(Ⅲ),這是最早使用的有機試劑,也是最早的試紙。
1751年,J.T.埃勒爾·馮·布羅克豪森用同一方法檢出血渣(經灰化)中的含鐵量。
容量分析
1663年,玻意耳報道了用植物色素作酸鹼指示劑。但真正的容量分析應歸功於法國J.-L.蓋-呂薩克。
1824年,他發表漂白粉中有效氯的測定,用磺化靛青作指示劑。隨後他用硫酸滴定草木灰,又用氯化鈉滴定硝酸銀。這三項工作分別代表氧化還原滴定法、酸鹼滴定法和沉澱滴定法。絡合滴定法創自J.von李比希,他用銀(Ⅰ)滴定氰離子。另一位對容量分析作出卓越貢獻的是德國K.F.莫爾,他設計的可盛強鹼溶液的滴定管至今仍在沿用。他推薦草酸作鹼量法的基準物質,硫酸亞鐵銨(也稱莫爾鹽)作氧化還原滴定法的基準物質。
微量分析
最早的微量分析是化學顯微術,即在顯微鏡下觀察樣品或反應物的晶態、光學性質、顆粒尺寸和圓球直徑等。
17世紀中葉,R.胡克從事顯微鏡術的研究,並於1665年出版《顯微圖譜》。法國藥劑師F.A.H.德卡羅齊耶在1784年用顯微鏡以氯鉑酸鹽形式區別鉀、鈉。
1747年,德意志化學家A.S.馬格拉夫用顯微鏡證實蔗糖和甜菜糖實為同一物質;
1756年,用顯微鏡檢驗鉑族金屬。
1865年,A.黑爾維希著《毒物學中之顯微鏡》。
1877年,S.A.博里基著《以化學/顯微鏡法作礦物與岩石分析》,並使用氣體試劑(如氟化氫、氯)、氟硅酸和硫化銨與礦物及其切片作用。T.H.貝侖斯不僅從事無機物的晶體檢驗,還擴充到有機晶體。
1891年,O.萊爾曼提出熱顯微術,即在顯微鏡下觀察晶體遇熱時的變化。L.科夫勒及其夫人設計了兩種顯微鏡加熱台,便於研究藥物及有機化合物的鑒定。熱顯微術只需一粒晶體。後來又發展到電子顯微鏡,解析度可達1埃。
不用顯微鏡的最早的微量分析者應推德國J.W.德貝賴納。他從事濕法微量分析,還有吹管法和火焰反應,並發表了《微量化學實驗技術》一書。公認的近代微量分析奠基人是F.埃米希。他設計和改進微量化學天平,使其靈敏度達到微量化學分析的要求,改進和提出新的操作方法,實現毫克級無機樣品的測定,並證實納克級樣品測定的精確度不亞於毫克級測定。有機微量定量分析奠基人是F.普雷格爾,他曾從膽汁中離析一降解產物,其量尚不足作一次常量碳氫分析,在聽了埃米希於1909年所作的有關微量定量分析的講演並參觀其實驗室后,他決意將常量燃燒法改為微量法(樣品數毫克),並獲得成功;1917年出版《有機微量定量分析》一書,並在1923年獲諾貝爾化學獎。
常量操作如不適用於微量分析則需改進。例如,常量過濾是將沉澱定量移入濾紙錐中或過濾坩堝中。若用此法於微量沉澱過濾,則在原進行沉澱的燒杯壁所粘附的物質就不能再忽略不計了,所以必須改變辦法。微量過濾採用濾棒吸出母液,而留全部沉澱於容器中。容器可用25毫升瓷坩堝,它兼用作稱量器皿;還可在其內洗滌沉澱,然後再用濾棒吸出洗液。這樣既可避免沉澱損失,又可簡化操作手續。
無機化合物在濾紙上的行為在19世紀中已引起注意。德意志化學家F.F.龍格在1850年將染料混合液滴在吸墨紙上使之分離。更早些時候他用染有澱粉和碘化鉀溶液的濾紙或花布塊作漂白液的點滴試驗。他又用浸過硫酸鐵(Ⅲ)和銅(Ⅱ)溶液的紙,在其中部滴加黃血鹽,等每滴吸入后再加第二滴,因此獲得自行產生的美麗圖案。1861年出現C.F.舍恩拜因的毛細管分析,他將濾紙條浸入含數種無機鹽的水中,水攜帶“鹽類”沿紙條上升,以水升得最高,其他離子依其“遷移率”而分離成為連接的帶。這與“紙層析”極為相近。他的學生研究於“濾紙上分離有機化合物”獲得成功,能明顯而完全分離“有機染料”。
用濾紙或瓷板進行無機、有機物的檢出是普雷格爾的貢獻。方法簡單而易行,選擇性和靈敏度均高,點滴試驗屬微量分析範圍。所著《點滴試驗》和《專一、選擇和靈敏反應的化學》兩書,為從事分析者所必讀。1921年後奧地利F.法伊格爾系統地發展了點滴試驗法。
20世紀60年代,H.魏斯提出環爐技術。僅用微克量樣品置濾紙中心,繼用溶劑淋洗,而在濾紙外沿加熱以蒸發溶劑,遂分離為若干同心環。如離子無色可噴以靈敏的顯色劑或熒光劑。既能檢出,又能得半定量結果。
色譜法
色譜法也稱層析法,基本上是分離方法。
1906年,俄國М.С.茨維特將綠葉提取汁加在碳酸鈣沉澱柱頂部,繼用純溶劑淋洗,從而分離了葉綠素。此項研究發表在德國《植物學》雜誌上,故未能引起人們注意。
1931年,德國R.庫恩和E.萊德爾再次發現本法並顯示其效能,人們才從文獻中追溯到茨維特的研究和更早的有關研究,如1850年J.T.韋曾利用土壤柱進行分離;1893年L.里德用高嶺土柱分離無機鹽和有機鹽。四年後D.T.戴用漂白土分離石油。
氣體吸附層析始於20世紀30年代的P.舒夫坦和A.尤肯。40年代,德國Y.黑塞利用氣體吸附以分離揮發性有機酸。英國E.格盧考夫也用同一原理在1946年分離空氣中的氦和氖,並在1951年製成氣相色譜儀(見氣相色譜法)。第一台現代氣相色譜儀研製成功應歸功於E.克里默。
氣體分配層析法根據液液分配原理,由英國A.J.P.馬丁和R.L.M.辛格於1941年提出。由於此工作之重要,他們獲得1952年諾貝爾化學獎。M.J.E.戈萊提出用長毛細管柱,是另一創新。
色譜-質譜聯用法中將色譜法所得之淋出流體移入質譜儀,可使複雜的有機混合物在數小時內得到分離和鑒定,是最有效的分析方法之一。
液相色譜法包括液-液和液-固色譜,后兩個名稱之第一物態代表流動相,第二物態代表固定相。在大氣壓力下,液相色譜流速太低,因此須增加壓強。這方面的先驅工作是P.B.哈密頓在1960年用高壓液相色譜分離氨基酸。
1963年,J.C.吉丁斯指出,液相色譜法的柱效要趕上氣相色譜法,則前者填充物顆粒應小於後者顆粒甚多,因此需要大壓強,所用的泵應無脈衝。
1966年,R.詹特福特和T.H.高製成這種無脈衝泵。
1969年,J.J.柯克蘭改進填充物,使之具有規定的表面孔度,再將固定相(如正十六烷基)鍵合在載體上,使之能抗熱和抗溶劑分解。載體可用二氧化硅,鍵合通過Si-O-C或Si-C鍵。
薄層層析
薄層層析採用薄層硅膠等代替濾紙進行層析。由於硅膠顆粒均勻而細微,分離的速度和程度一般優於紙層析,分離無機物和有機物時與紙層析一樣有效。
荷蘭生物學家M.W.拜爾因克在1889年滴一滴鹽酸和硫酸的混合液於動物膠薄層中部,鹽酸擴散遠些,在硫酸環之外另成一環,相繼用硝酸銀和氯化鋇顯示這兩個環的存在。
9年後H.P.維伊斯曼用同樣方法證明麥芽的澱粉酶中實含兩種酶。
直至1956年聯邦德國E.施塔爾改善塗布方法和操作,採用細顆粒(0.5~5微米)硅膠等措施,才使該法得到廣泛使用。定量薄層層析始於J.G.基施納等(1954)。他們最先測定橙柑屬及其加工品中的聯苯(見薄層層析)。
熱分析
希臘哲學家泰奧弗拉斯圖斯曾記錄各種岩石礦物及其他物質遇熱所發生的影響。法國H.-L.勒夏忒列和英國W.C.羅伯茨-奧斯汀同稱為差熱分析的鼻祖。
20世紀60年代,出現精細的差熱分析儀和M.J.奧尼爾提出的差示掃描量熱法,它能測定化合物的純度及其他參數,如熔點和玻璃化、聚合、熱降解、氧化等溫度(見熱分析)。
20世紀初,提出的熱重量法是研究物質,如鋼鐵、沉澱等遇熱時重量之變化。本多光太郎創製第一架熱天平,它最初只用於解決冶金方面的問題。將它用於分析方面的當推C.杜瓦爾。他曾研究過1000多種沉澱的熱行為。例如草酸鈣用高溫可灼燒為氧化鈣,也可在約550°C灼燒為碳酸鈣。二者作為稱量形式,則以後者為佳,因灼燒時既省能量,換算因子值較大(因此誤差較小),又免氧化鈣在稱量時吸潮。
電解時,銅(Ⅱ)在陰極還原而以單質(零價)析出,再進行稱量,應歸入重量法。此時可認為電子是沉澱劑。還有鉛(Ⅱ)在陽極氧化,以二氧化鉛形式附於陽極。前法在19世紀60年代分別由德意志C.盧科和美國J.W.吉布斯獨立提出。
有機試劑
19世紀初,用於無機重量分析的有機試劑只有草酸及其銨鹽和琥珀酸銨兩種。前者用於鈣、鎂分離和鈣的測定。後者用於沉澱三價鐵使它與二價金屬離子分離。
1885年,M.A.伊林斯基和G.von克諾雷提出1-亞硝基-2-萘酚作為鎳存在時鈷的沉澱劑,同時也是第一個螯合劑。至於陰離子測定,在20世紀初,W.米勒提出4,4-聯苯胺作為硫酸根的沉澱劑。
1950年,中國梁樹權等將有機試劑用於重量分析,測定鎢酸根。
1950年,M.布希引入4,5-二氫-1,4-二苯基-3,5-苯亞氨基-1,2,4-三氮雜茂(簡稱硝酸根試劑)作為硝酸根沉澱劑。1975年後,它又成為高錸酸根的良好沉澱劑。
1950年,Л.A.楚加耶夫合成了丁二肟,並觀察到它與鎳(Ⅱ)形成紅色沉澱。兩年後,聯邦德國O.E.布龍克把丁二肟試劑應用於鋼中鎳的測定。嗣後靈敏的和選擇性高的新有機試劑不斷出現。中國曾雲鶚等合成3-(2-胂酸基苯偶氮)-6-(2,6-二溴-4-氯苯偶氮)-4,5-二羥基-2,7-萘二磺酸,用此試劑時,稀土元素的摩爾吸光係數可以高達0.98~1.2×10升/(摩·厘米)。
光度分析
它是基於被測物質的分子對光具有選擇性吸收的特性而建立起來的分析方法。包括比色分析法和紫外、可見分光光度法。測量某溶液對不同波長單色光的吸收程度,以波長為橫坐標,吸光度為縱坐標作圖,可得到吸收光譜。根據各種物質所有的特殊吸收光譜,可進行定性分析和定量分析。
比色法以日光為光源,靠目視比較顏色深淺。最早的記錄是1838年W.A.蘭帕迪烏斯在玻璃量筒中測定鈷礦中的鐵和鎳,用標準參比溶液與試樣溶液相比較。
1846年,A.雅克蘭提出根據銅氨溶液的藍色測定銅。隨後有T.J.赫羅帕思的硫氰酸根法測定鐵(1852);奈斯勒法測定氨;苯酚二磺酸法測定硝酸根(1864);過氧化氫法測定鈦(1870);亞甲基藍法測定硫化氫(1883);磷硅酸法測定二氧化硅(1898)。分光光度計使用單色光和光電倍增管,波長範圍為220~1000納米,比目視範圍(400~700納米)更寬。
用光照射懸浮液,從頂部觀察,當視線與光線成直角時,稱為比霧法;如果視線與光線在一條直線上時,稱為比濁法。
18世紀50年代,G.J.馬爾德在原子量測定中,利用了目測上層液體中氯化銀懸浮液的亮度。隨後,J.-S.斯塔改用一標準懸浮液作參比。
1894年,美國T.W.理查茲設計出第一台比霧計。比霧法最初用於觀測原子量測定中母液中的氯(或溴)離子和銀離子濃度是否達到當量。隨後此法用於定量測定,其靈敏度很高,可測定一升水所含的3微克磷,或一升水所含的10微克丙酮。
分子光譜分析
紅外光譜是有機化學家鑒別未知化合物的有力手段。紅外光譜在20年代開始應用於汽油爆震研究,繼用於鑒定天然和合成橡膠以及其他有機化合物中的未知物和雜質。70年代,在電子計算機蓬勃發展的基礎上,傅立葉變換紅外光譜(FTIR)實驗技術進入現代化學家的實驗室,成為結構分析的重要工具。遠紅外光譜(200~10厘米)和微波譜(10~0.1厘米)是研究分子旋轉的光譜法。
拉曼光譜(見拉曼光譜學是研究分子振動的另一種方法。早期拉曼光譜的信號太弱,使用困難,直至用激光作為單色光源后,才促進其在分析化學中的應用。拉曼光譜發展到現今已有採用傅立葉變換技術的FT-Raman光譜分析技術,共聚焦顯微拉曼光譜分析技術,表面增強拉曼效應分析技術等,在生物醫學分析、文物分析、寶石鑒定、礦物分析等領域有重要的作用。
原子發射光譜法
1672年,I.牛頓在暗室中用稜鏡分日光為七色,這就是原子發射光譜法的始祖。
1800年,F.W.赫歇耳發現紅外線。次年J.W.里特用氯化銀還原現象發現紫外區。又次年W.H.渥拉斯頓觀察到日光光譜的暗線。
1815年,J.von夫琅和費經過研究,命名暗線為夫琅和費線。文獻中稱鈉線為D線,也是夫琅和費規定的。R.W.本生髮明了名為本生燈的煤氣燈,燈的火焰近於透明而不發光,便於光譜研究。
1859年,本生和他的同事物理學家G.R.基爾霍夫研究各元素在火焰中呈示的特徵發射和吸收光譜,並指出日光光譜中的夫琅和費線是原子吸收線,因為太陽的大氣中存在各種元素。他們用的儀器已具備現代分光鏡的要素。他們可稱為發射光譜法的創始人。
電化學分析法
W.H.能斯脫在1889年提出了能斯脫公式,將電動勢與離子濃度、溫度聯繫起來,奠定了電化學的理論基礎。隨後,電化學分析法有了發展,電沉積重量法、電位分析法、電導分析法、安培滴定法、庫侖滴定法、示波極譜法相繼出現。氫電極、玻璃電極和離子選擇性電極陸續製成。尤以極譜分析技術貢獻卓著。
無機分析和有機分析
天然產物和工業製品中的無機物,如岩石、礦物、陶瓷、鋼鐵、合金、礦物酸、燒鹼等的分析屬無機分析;石油、染料、塑料、食品、合成藥物、中草藥等的分析屬有機分析。簡言之,凡碳氫化合物及其衍生物的分析屬有機分析,而除上述物質外的分析統屬無機分析。不過,無機物中有時夾雜一些有機物質,而有機物也含有無機物質。例如,河水、海水中含有有機物,有些錳礦夾雜有機物,煤含有灰分,石油含有以絡合物形式存在的金屬,紙張中有無機填充物等。這類物品既用到無機分析,也用到有機分析。
還有一些方法對無機物質和有機物質同樣有效,如氣相色譜法便是其中之一。樣品中一氧化碳、二氧化碳、氫、氮、氧、甲烷、乙烯、水氣等在同一柱中,在選擇的條件下可逐一分離或分組分離。奧薩特氣體分析器也是如此,只是分離的原理不同。
痕量分析是指樣品所含的量極為微少。一般在樣品中含量多的為主要成分,含量少的為次要成分。E.B.桑德爾認為含量在1%~0.01%的為次要成分。有人認為在10%~0.01%的為次要成分。含量在萬分之一(0.01%)以下稱為痕量。痕量分析的動向趨於測定愈來愈低的含量,因此出現了超痕量分析,即含量接近或低於一般痕量下限。這名稱只是定性的。定量或更明確的名稱見下列規定:
痕量10~10微克/克
微痕量10~10微克/克
納痕量10~10微克/克
沙痕量10~10微克/克
微克/克微痕量分析尚另有一種意義,即使用微量分析的稱樣,而測定其中痕量元素(例如<10微克/克)。為與前述一詞區分,后一詞應稱為微樣痕量分析。
分析化學是研究物質組成的科學,它包括化學分析、儀器分析兩部分。化學分析是基礎,儀器分析是新世紀的發展方向。
分析化學
化學分析包括滴定分析和稱量分析,它是根據物質的化學性質來測定物質的組成及相對含量。
光譜學
質譜學
分光度和比色法
層析和電泳法
結晶學
顯微術
電化學分析
古典分析
雖說當代分析方法絕大部分為儀器分析,但有些儀器最初的設計目的,是為了簡化古典方法的不便,基本原理仍來自於古典分析。另外,樣品配置等前置處理,仍需要藉由古典分析手法的協助。以下舉一些古典分析方法:
滴定法
重量分析
無機定性分析
儀器分析
分析儀器:當代分析化學著重儀器分析,常用的分析儀器有幾大類,包括原子與分子光譜儀,電化學分析儀器,核磁共振,X光,以及質譜儀。儀器分析之外的分析化學方法,統稱為古典分析化學。
分析化學是化學的一個重要分支,它主要研究物質中有哪些元素或基團(定性分析);每種成分的數量或物質純度如何(定量分析);原子如何聯結成分子,以及在空間如何排列等等。
儀器分析分類表
儀器分析的方法:它是根據物質的物理性質或物質的物理化學性質來測定物質的組成及相對含量。儀器分析根據測定的方法原理不同,可分為電化學分析、光學分析、色譜分析、其他分析法等4大類。如右圖。
主要分析儀器:
原子吸收光譜法(Atomicabsorptionspectroscopy,AAS)
原子熒光光譜法(Atomicfluorescencespectroscopy,AFS)
α質子-X射線光譜儀(AlphaparticleX-rayspectrometer,APXS)
毛細管電泳分析儀(Capillaryelectrophoresis,CE)
色譜法(Chromatography)
比色法(Colorimetry)
循環伏安法(CyclicVoltammetry,CV)
差示掃描量熱法(Differentialscanningcalorimetry,DSC)
電子順旋共振儀(Electronparamagneticresonance,EPR)
電子自旋共振(Electronspinresonance,ESR)
橢圓偏振技術(Ellipsometry)
場流分離法(Fieldflowfractionation,FFF)
傳式轉換紅外線光譜術(FourierTransformInfraredSpectroscopy,FTIR)
氣相色譜法(Gaschromatography,GC)
氣相色譜-質譜法(Gaschromatography-massspectrometry,GC-MS)
高效液相色譜法(HighPerformanceLiquidChromatography,HPLC)
離子微探針(IonMicroprobe,IM)
感應耦合電漿(Inductivelycoupledplasma,ICP)
Instrumentalmassfractionation(IMF)
選擇性電極(Ionselectiveelectrode,ISE)
激光誘導擊穿光譜儀(LaserInducedBreakdownSpectroscopy,LIBS)
質譜儀(Massspectrometry,MS)
穆斯堡爾光譜儀系統(Mossbauerspectroscopy)
核磁共振(Nuclearmagneticresonance,NMR)
粒子誘發X-射線產生(ParticleinducedX-rayemissionspectroscopy,PIXE)
熱裂解-氣相色譜-質譜儀(Pyrolysis-GasChromatography-MassSpectrometry,PY-GC-MS)
拉曼光譜(Ramanspectroscopy)
折射率
共振增強多光子電離譜(Resonanceenhancedmulti-photonionization,REMPI)
掃瞄穿透X射線顯微鏡(ScanningtransmissionX-raymicroscopy,STXM)
薄板層析(Thinlayerchromatography,TLC)
穿透式電子顯微鏡(Transmissionelectronmicroscopy,TEM)
X射線熒光光譜儀(X-rayfluorescencespectroscopy,XRF)
X射線顯微鏡(X-raymicroscopy,XRM)
分析化學的比較
化學分析與儀器分析方法比較表:
| 項目 | 化學分析法(經典分析法) | 儀器分析法(現代分析法) |
| 物質性質 | 化學性質 | 物理、物理化學性質 |
| 測量參數 | 體積、重量 | 吸光度、電位、發射強度等等 |
| 誤差 | 1%~2%或更高 | |
| 組分含量 | 1%~100% | |
| 理論基礎 | 化學、物理化學(溶液四大平衡) | 化學、物理、數學、電子學、生物等等 |
| 解決問題 | 定性、定量 | 定性、定量、結構、形態、能態、動力學等全面的信息 |
徠理想條件
①選擇性最高,以至具有專一性,即干擾極少,這樣就可以減少或省略分離步驟;
②精密度和準確度最高;
③靈敏度最高,從而少量或痕量組分即可檢定和測定;
④測定範圍最廣,大量和痕量均能測定;
⑤能測定的元素種類和物種最多;
⑥方法簡便,即最易操作而不需高度技巧;
⑦經濟實惠,即要求費用少而收益大。但彙集所有優點於一法是辦不到的,例如,在重量分析中,如要提高準確度,需要延長分析時間(如用重沉澱法純化沉澱)。因為化學法測定原子量要求準確到十萬分之一,所以最費時間。
分離和富集方法
雖然有不少靈敏的和選擇性強(甚至專一)的方法,但是如果欲測元素的濃度接近或低於方法的測定下限,則富集仍不可避免。富集方法很多,如升華、揮發、蒸餾、泡沫浮選(見痕量富集)、吸附(用分子篩、活性炭等)、色譜法、共沉澱、共結晶、汞齊作用、選擇溶解、溶劑萃取、離子交換等。
在檢出或測定之前,常常需要使欲測(或檢出)物質與干擾物質彼此分離。重要的分離方法有蒸餾、溶劑萃取、離子交換、電滲析、沉澱、電泳等,大都與富集方法相同。富集可認為是提高濃度的分離方法。
隱蔽作用(見隱蔽和解蔽)雖不是分離,但其作用使離子失去其正常性質,即令該離子以另一形式存於反應體系中。然而在分析化學中分離之目的無非使干擾離子不再干擾,因此就廣義而言,隱蔽及其相反作用解蔽應包括在分離範疇中。在分析化學中採用隱蔽和解蔽作用由來已久。重量分析、光度法、極譜法中均已應用,特別在點滴試驗和絡合滴定法中使用得更頻繁。
取樣和試樣分解
取樣最重要的要求是有代表性,即取來欲分析的樣品須能代表全體。均勻或容易混勻的物質取樣自不成問題,氣態和液態樣品屬於這一類。不均勻的固態物質,如礦石和煤炭等應按規定手續取樣。否則,分析結果不能代表原物質,徒然浪費人力物力。野外礦石取樣多由地質人員進行。所得大樣在試驗室中由分析人員按一定手續粉碎和縮分到小樣。另一方面,有機元素燃燒法分析合成的純樣品則無此問題。
樣品溶熔是第二步。溶熔包括溶解和熔融,也稱分解。有些樣品能溶解於水、酸或混合酸、鹼,以及有機溶劑中。上述辦法不能溶解的,可改用熔劑熔融。熔劑可分鹼性(如碳酸鈉)、酸性(如硫酸氫鉀)、氧化性(如過氧化鈉)和還原性的(如硫代硫酸鈉)。如果欲分析的成分較易揮發或熔融溫度高,對坩堝腐蝕嚴重,則可改用燒結,即將顆粒表面部分熔化。史密斯法用氯化銨和碳酸鈣(1:8~12)與硅酸鹽岩石混合和燒結,以測定其中的鹼金屬便是一例。有機化合物和生物樣品可採用干法或濕法灰化。干法灰化為在充分氧氣存在下加熱至炭化並逐漸燃燒,或在較低溫度用原子氧氧化(低溫灰化)。濕法灰化利用氧化性酸(如硝酸、高氯酸、濃硫酸)氧化樣品。干法、濕法各有其優缺點,須視樣品而定。
對照實驗
對照試驗是檢驗分析過程中有無系統誤差的有效方法。用含量已知的標準試樣或純物質,以同一方法按完全相同的條件,平行測定,由分析結果與已知含量的誤差對結果進行校正,可減免系統誤差。
對於新建立的分析方法,一般要求與經典方法對照,對同一試樣進行測量,比較測量結果的精密度與準確度,以判斷所建方法的可行性。
回收試驗
當無法獲得標準試樣時,分析方法的準確度用回收試驗的結果來衡量。回收試驗是先用所建方法測出試樣中某組分含量,再取幾份相同試樣(n≥5),各加入適量待測組分的純品,按相同條件進行測定
回收率越接近100%,系統誤差越小,方法準確度越高。回收率偏低可能是樣品製備不當、提取不完全或方法本身的系統誤差所致;回收率偏高則可能和方法選擇性差,雜質干擾等因素有關。回收試驗常在微量組分分析中應用。
空白試驗
空白試驗是採用和測定試樣完全相同的方法、儀器和試劑,但不加入試樣的情況下進行的分析試驗。所得結果成為空白值,從試驗的分析結果中扣除空白值,可消除由試劑、溶劑及試驗器皿等引入的雜質所造成的誤差。
發展簡史
分析化學這一名稱雖創自玻意耳,但其實踐運用與化學工藝的歷史同樣古老。古代冶鍊、釀造等工藝的高度發展,都是與鑒定、分析、製作過程的控制等手段密切聯繫在一起的。在東、西方興起的煉丹術、鍊金術等都可視為分析化學的前驅。
古代化學的發展
公元前3000年,埃及人已經掌握了一些稱量的技術。最早出現的分析用儀器當屬等臂天平,它在公元前1300年的《莎草紙卷》上已有記載。巴比倫的祭司所保管的石制標準砝碼(約公元前2600)尚存於世。不過等臂天平用於化學分析,當始於中世紀的烤缽試金法中。
古代認識的元素,非金屬有碳和硫,金屬中有銅、銀、金、鐵、鉛、錫和汞。公元前四世紀已使用試金石以鑒定金的成色,公元前三世紀,阿基米德在解決敘拉古王喜朗二世的金冕的純度問題時,即利用了金、銀密度之差,這是無傷損分析的先驅。
公元60年左右,老普林尼將五倍子浸液塗在莎草紙上,用以檢出硫酸銅的摻雜物鐵,這是最早使用的有機試劑,也是最早的試紙。遲至1751年,埃勒爾·馮·布羅克豪森用同一方法檢出血渣(經灰化)中的含鐵量。
火試金法是一種古老的分析方法。遠在公元前13世紀,巴比倫王致書埃及法老阿門菲斯四世稱:“陛下送來之金經入爐后,重量減輕……”這說明3000多年前人們已知道“真金不怕火煉”這一事實。法國菲利普六世曾規定黃金檢驗的步驟,其中提出對所使用天平的構造要求和使用方法。
18-19世紀
18世紀的瑞典化學家貝格曼可稱為無機定性、定量分析的奠基人。他最先提出金屬元素除金屬態外,也可以其他形式離析和稱量,特別是水中難溶的形式,這是重量分析中濕法的起源。
德國化學家克拉普羅特不僅改進了重量分析的步驟,還設計了多種非金屬元素測定步驟。他準確地測定了近200種礦物的成分及各種工業產品如玻璃、非鐵合金等的組分。
18世紀分析化學的代表人物首推貝采利烏斯。他引入了一些新試劑和一些新技巧,並使用“無灰濾紙”、“低灰分濾紙”和“洗滌瓶”。他是第一位把原子量測得比較精確的化學家。除無機物外,他還測定過“有機物中元素的百分數”。他對吹管分析尤為重視,即將少許樣品置於“炭塊凹處”,用“氧化”或“還原焰”加熱,以觀察其變化,從而獲得有關樣品的定性知識。此法一直沿用至19世紀,其優點是迅速和所需要的樣品量少,又可用於野外勘探和普查礦產資源等。
19世紀分析化學的傑出人物之一是弗雷澤紐斯,他創立一所分析化學專業學校(此校至今依然存在);並在1862年創辦德文的《分析化學》雜誌,其後人連任主編至今。他編寫的《定性分析》、《定量分析》兩本書編譯為多種文字,包括晚清時代出版的中譯本,定名為《化學考質》和《化學求數》。他將定性分析的“陽離子硫化氫系統”修訂為的五組,還注意到“酸鹼度對金屬硫化物沉澱”的影響。在容量分析中,他提出用二氯化錫滴定三價鐵至黃色消失。
1663年波義耳報道了用植物色素作酸鹼指示劑,這是容量分析的先驅。但真正的容量分析應歸功於法國蓋·呂薩克。1824年他發表“漂白粉中有效氯的測定”,用“磺化靛青”作指示劑。隨後他用硫酸滴定“草木灰”,又用氯化鈉滴定“硝酸銀。”這三項工作分別代表氧化還原滴定法、酸鹼滴定法和沉澱滴定法。絡合滴定法創自李比希,他用銀滴定氰離子。
另一位對容量分析作出卓越貢獻的是德國莫爾,他設計的“可盛強鹼溶液的滴定管”至今仍在沿用。他推薦草酸作鹼量法的基準物質,硫酸亞鐵銨(也稱莫爾鹽)作氧化還原滴定法的基準物質。
最早的“微量分析”是“化學顯微術”,即在顯微鏡下觀察樣品或反應物的“晶態”、“光學性質”、“顆粒尺寸”和“圓球直徑”等。17世紀中葉胡克從事顯微鏡術的研究,並於1665年出版《顯微圖譜》。法國藥劑師德卡羅齊耶在1784年用顯微鏡以氯鉑酸鹽形式區別鉀、鈉。德意志化學家馬格拉夫在1747年用顯微鏡證實蔗糖和甜菜糖實為同一物質;在1756年用顯微鏡檢驗鉑族金屬。1891年,萊爾曼提出熱顯微術,即在顯微鏡下觀察晶體遇熱時的變化。科夫勒及其夫人設計了兩種顯微鏡加熱台,便於研究藥物及有機化合物的鑒定。後來又發展到電子顯微鏡,解析度可達1埃。
不用顯微鏡的最早的微量分析者應推德國德貝賴納。他從事“濕法微量分析”,還有吹管法和火焰反應,並發表了《微量化學實驗技術》一書。近代微量分析奠基人是埃米希,他設計和改進微量化學天平,使其靈敏度達到微量化學分析的要求;改進和提出新的操作方法,實現毫克級無機樣品的測定,並證實納克級樣品測定的精確度不亞於毫克級測定。
有機微量定量分析奠基人是普雷格爾,他曾從膽汁中離析出一種降解產物,其量尚不足作一次常量碳氫分析。在聽了埃米希於1909年所作有關微量定量分析的講演並參觀其實驗室后,他決意將常量燃燒法改為微量法(樣品數毫克),並獲得成功;1917年出版《有機微量定量分析》,並在1923年獲諾貝爾化學獎。
德國化學家龍格在1850年將染料混合液滴在吸墨紙上使之分離,更早些時候他曾用染有澱粉和碘化鉀溶液的濾紙或花布塊作過漂白液的點滴試驗。他又用浸過硫酸鐵和銅溶液的紙,在其中部滴加“黃血鹽”,等每滴吸入后再加第二滴,因此獲得自行產生的美麗圖案。1861年出現舍恩拜因的毛細管分析,他將濾紙條浸入“含數種無機鹽”的水中,水攜帶“鹽類”沿紙條上升,以水升得最高,其他離子依其遷移率而分離成為連接的帶。這與紙層析極為相近。他的學生研究於濾紙上分離有機化合物獲得成功,能明顯而完全分離有機染料。
20世紀60年代,魏斯提出環爐技術。僅用微克量樣品置濾紙中,繼用溶劑淋洗,而後在濾紙外沿加熱以蒸發溶劑,遂分離為若干同心環。如離子無色可噴以靈敏的顯色劑或熒光劑,既能檢出,又能得半定量結果。
發展概述
火試金法是久經考驗的一種分析方法。遠在公元前13世紀,巴比倫王致書埃及法老阿門菲斯四世稱:“陛下送來之金經入爐后,重量減輕……。”這說明3000多年前人們已知道“真金不怕火煉”這一事實。14世紀時,在歐洲已用法律規定烤缽試金法為檢驗黃金的手段。匈牙利王查理一世曾令每一礦城須建立一個火試金試驗室。法國國王菲利普六世曾規定黃金檢驗的步驟,其中並提出對所使用天平的構造要求和使用方法,如天平不應置於受風吹或寒冷之處,使用者的呼吸不得影響天平的稱量等。
1540年出版的《火技藝》一書已詳述用骨灰製作烤缽和灰吹法。隨後不久,火試金法即推廣至某些賤金屬,特別是銅和鉛礦石分析。德意志G.阿格里科拉在其名著《坤輿格致》第七章中,系統敘述火試金法。本法又稱干法,適用於能從樣品中以粒狀或鈕扣狀析出的金屬,而不適用於非金屬。
定性分析和定量分析 瑞典化學家T.O.貝格曼可稱為無機定性、定量分析的奠基人。他首先提出金屬元素除金屬態外,也可以其他形式離析和稱量,特別是以水中難溶的形式,這是重量分析中濕法的起源。當時還沒有原子量,也沒有化合物的分子式。他的換算因子是由實驗直接獲得的。
德意志化學家M.H.克拉普羅特不僅改進了重量分析的步驟,還設計了多種非金屬元素測定步驟。他準確地測定了近200種礦物的成分及各種工業產品如玻璃、非鐵合金等的組分。
18世紀分析化學的代表人物首推J.J.貝采利烏斯。他引入了一些新試劑(如氫氟酸用於分解硅酸鹽岩石和二氧化硅測定)和一些新技巧,並使用無灰濾紙、低灰分濾紙和洗滌瓶。他是第一位把原子量測得比較精確的化學家。除無機物外,他還測定過有機物中元素的百分數。他對吹管分析尤為重視。吹管分析可認為是冶金操作之微型化,即將少許樣品置於炭塊凹處,用氧化或還原焰加熱,以觀察其變化,從而獲得有關樣品的定性知識。此法沿用至19世紀,其優點是迅速、所需樣品量少,又可用於野外勘探和普查礦產資源等。
19世紀分析化學的傑出人物之一是C.R.弗雷澤紐斯,他創立一所分析化學專業學校,至今此校仍存在;並於1862年創辦德文的《分析化學》雜誌,由其後人繼續任主編至今。他編寫的《定性分析》、《定量分析》兩書曾譯為多種文字,包括晚清時代出版的中譯本,分別定名為《化學考質》和《化學求數》。他將定性分析的陽離子硫化氫系統修訂為五組,還注意到酸鹼度對金屬硫化物沉澱的影響。在容量分析中,他提出用二氯化錫滴定三價鐵至黃色消失。
(一)、農業:
土壤
農藥
化肥
(二)、工業生產:
質檢(產品、原材料)
(三)、環境保護:
環境監測(大氣、水、土壤分析等)
測定空氣中污染物如NO2,SO2,CO等含量,這兩者不僅對人體呼吸道有影響,而且造成酸雨。煙鎘會引起腎功能衰退,吸入過多會頭痛,頭暈,嘔吐,胸痛,死亡。
(四)、體育
興奮劑檢測。
(五)、刑事偵破
各人頭髮中微量元素含量不同,通過測定可判斷現場
的頭髮是誰的
