酸鹼指示劑
酸鹼指示劑
用於徠酸鹼滴定的指示劑,稱為酸鹼指示劑。是一類結構較複雜的有機弱酸或有機弱鹼,它們在溶液中能部分電離成指示劑的離子和氫離子(或氫氧根離子),並且由於結構上的變化,它們的分子和離子具有不同的顏色,因而在pH不同的溶液中呈現不同的顏色。
酸鹼指示劑指的是用於酸鹼滴定的指示劑,英文名稱:acid-base indicator。

常見的酸鹼指示劑
酸鹼指示劑是檢驗溶液酸鹼性的常用化學試劑,像科學上的許多其它發現一樣,酸鹼指示劑的發現是化學家善於觀察、勤于思考。勇於探索的結果。

酸鹼指示劑
他還採集了藥草、牽牛花,苔蘚、月季花、樹皮和各種植物的根……泡出了多種顏色的不同浸液,有些浸液遇酸變色,有些浸液遇鹼變色,不過有趣的是,他從石蕊苔蘚中提取的紫色浸液,酸能使它變紅色,鹼能使它變藍色,這就是最早的石蕊試液,波義耳把它稱作指示劑。為使用方便,波義耳用一些浸液把紙浸透、烘乾製成紙片,使用時只要將小紙片放入被檢測的溶液,紙片上就會發生顏色變化,從而顯示出溶液是酸性還是鹼性。今天,我們使用的石蕊、酚酞試紙、pH試紙,就是根據波義耳的發現原理研製而成的。
後來,隨著科學技術的進步和發展,許多其它的指示劑也相繼被另一些科學家所發現。
常用的酸鹼指示劑主要有以下四類:
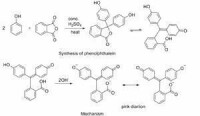
酸鹼指示劑
2、酚酞類 有酚酞、百里酚酞和α-萘酚酞等,它們都是有機弱酸。
3、磺代酚酞類 有酚紅、甲酚紅、溴酚藍、百里酚藍等,它們都是有機弱酸。
鹼徠指示劑應該選用甲基橙作指示劑。

酸鹼指示劑
指示劑用量過多,還會影響變色的敏銳性。例如:以甲基橙為指示劑,用HCl滴定NaOH溶液,終點為橙色,若甲基橙用量過多則終點敏銳性就較差。
2.溫度和溶劑
溫度的變化會引起指示劑電離常數和水的質子自遞常數發生變化,因而指示劑的變色範圍亦隨之改變,對鹼性指示劑的影響較酸性指示劑更為明顯。不同的溶劑具有不同的介電常數和酸鹼性,因而也會影響指示劑的電離常數和變色範圍。
3.指示劑的選擇
指示劑選擇不當,加之肉眼對變色點辨認困難,都會給測定結果帶來誤差。
因此,在多種指示劑中,選擇指示劑的依據是:要選擇一種變色範圍恰好在滴定曲線的突躍範圍之內,或者至少要佔滴定曲線突躍範圍一部分的指示劑。這樣當滴定正好在滴定曲線突躍範圍之內結束時,其最大誤差不過0.1%,這是容量分析容許的。
酸鹼指示劑既然都是一些有機弱酸或有機弱鹼,那麼在不同的酸鹼性溶液中,它們的電離程度就不同,於是會顯示不同的顏色。pH試紙則是由多種指示劑混合液製成的,通常情況下pH試紙就顯金黃色,pH≈5,可見在製作時,已將指示劑混合液調至弱酸性,並不是中性,這是為了減弱空氣中CO對測定的影響。此外,中和反應時,使用酸鹼指示劑只能用2~3滴,也是因為酸鹼指示劑都是有機酸或有機鹼,用多了會增大誤差的。

酸鹼指示劑
石蕊(主要成分用HL表示)在水溶液里能發生如下電離: HL←→H+L(H紅色, L藍色)
在酸性溶液里,紅色的分子是存在的主要形式,溶液顯紅色;在鹼性溶液里,上述電離平衡向右移動,藍色的離子是存在的主要形式,溶液顯藍色;在中性溶液里,紅色的分子和藍色的酸根離子同時存在,所以溶液顯紫色。
石蕊能溶於水,且能溶於酒精,變色範圍是pH 5.0~8.0
酚酞是一種有機弱酸,它在酸性溶液中,濃度較高時,形成無色分子。但隨著溶液中H濃度的減小,OH濃度的增大,酚酞結構發生改變,並進一步電離成紅色離子這個轉變過程是一個可逆過程,如果溶液中H濃度增加,上述平衡向反方向移動,酚酞又變成了無色分子。因此,酚酞在酸性溶液里呈無色,當溶液中H濃度降低,濃度升高時呈紅色。酚酞的變色範圍是pH 8.0~10.0。
酚酞的醌式或醌式酸鹽,在鹼性介質中是很不穩定的,它會慢慢地轉化成無色的羧酸鹽式因此做氫氧化鈉溶液使酚酞顯色實驗時,要用氫氧化鈉稀溶液,而不能用濃溶液。
在實際中,影響酸鹼指示劑變色範圍的因素主要有兩方面:一種是影響指示劑常數K的因素,包括溫度、溶劑、溶液的離子強度等,其中溫度的影響較大。另一種是影響變色範圍寬度的因素,如指示劑用量、滴定程序等,現具體討論如下。
1.溫度溫度改變時,指示劑常數K及水的離子積K均有改變,因此指示劑的變色範圍也隨之發生改變。例如,18℃時,甲基橙的變色範圍為3.1~4.4,而100℃時,變為2.5~3.7。因此,滴定宜在室溫下進行。如必須加熱,應該將溶液冷卻后再進行滴定。
2.溶劑 指示劑在不同溶劑中其pK值是不同的,因此在不同溶劑中的變色範圍不同。例如,甲基橙在水溶液中pK=3.4,在甲醇中pK=3.8。
3.中性電解質溶液中性電解質的存在增加了溶液的離子強度,使指示劑常數改變,影響到指示劑的變色範圍。此外,某些電解質還具有吸收不同波長光波的性質,會引起指示劑顏色深度、色調及變色靈敏度的改變。所以在滴定溶液中不宜有大量鹽類存在。
4.指示劑用量指示劑的用量(濃度)是一個重要因素。對於單色指示劑(如酚酞、百里酚酞),指示劑的用量對變色範圍有較大影響。從指示劑變色的平衡關係看出:
HIn←→H+In
設指示劑總濃度為c,人眼觀察到紅色鹼式的最低濃度為一固定值a,代入平衡式,則
K/[H]=[In]/[Hln]=a/(a-c)
式中,K是定值,如果c增大了,則[H]會相應增大,酚酞指示劑將在較低pH值變色。例如,在50~100ml溶液中加入2~3滴0.1%酚酞,在pH≈9時出現為紅色;而在同樣條件下,如加入15~20滴酚酞,在pH≈8時就會出現為紅色。因此.對單色指示劑須嚴格控制指示劑用量。
對於雙色指示劑,指示劑用量多少不會影響變色範圍。但溶液中指示劑的濃度大時可能致使終點時顏色變化不敏銳。另外指示劑本身也要消耗滴定劑.使滴定誤差增大。因此,指示劑用量一般少一些為宜,只要達到變色靈敏度,用量越少越好。
5.滴定程序溶液由淺色滴定到深色時,便於觀察終點顏色的變化。所以滴定程序宜是當指示劑顏色由酸式或鹼式色變為混合色時,溶液顏色由淺色變化到深色。例如,用酚酞作指示劑,滴定程序一般為用鹼滴定酸,終點由無色變為粉紅色,容易辨別。而用甲基橙作指示劑,一般用酸滴定鹼,終點由黃色變為橙色,易於辨認。
各種不同的酸鹼指示劑,具有不同的變色範圍,有的在酸性溶液中變色,如甲基橙、甲基紅等;有的在中性附近變色,如中性紅、苯酚紅等;有的則在鹼性溶液中變色,如酚酞、百里酚酞等。幾種常用酸鹼指示劑及其變色範圍列於下表。
| 幾種常用酸鹼指示劑 | |||||
|---|---|---|---|---|---|
| 指示劑 | 變色範圍 pH | 顏色變化 酸式 鹼式 | pK | 濃度 | 用量 滴/10ml |
| 百里酚藍 | 1.2~2.8 | 紅——黃 | 1.7 | 0.1%的20%乙醇溶液 | 1~2 |
| 甲基黃 | 2.9~4.0 | 紅——黃 | 3.3 | 0.1%的90%乙醇溶液 | 1 |
| 甲基橙 | 3.1~4.4 | 紅——黃 | 3.4 | 0.05%的水溶液 | 1 |
| 溴酚藍 | 3.0~4.6 | 黃——紫 | 4.1 | 0.1%的20%乙醇或其鈉鹽水溶液 | 1 |
| 溴甲酚綠 | 3.8~5.4 | 黃——藍 | 4.9 | 0.1%的20%乙醇或其鈉鹽水溶液 | 1~3 |
| 甲基紅 | 4.4~6.2 | 紅——黃 | 5.0 | 0.1%的60%乙醇或其鈉鹽水溶液 | 1 |
| 溴百里酚蘭 | 6.2~7.6 | 黃——藍 | 7.3 | 0.1%的20%乙醇或其鈉鹽水溶液 | 1 |
| 中性紅 | 6.8~8.0 | 紅——黃橙 | 7.4 | 0.1%的60%乙醇溶液 | 1 |
| 苯酚紅 | 6.7~8.4 | 黃——紅 | 8.0 | 0.1%的60%乙醇或其鈉鹽水溶液 | 1 |
| 酚酞 | 8.0~10.0 | 無——紅 | 9.1 | 0.5%的90%乙醇溶液 | 1~3 |
| 百里酚酞 | 9.4~10.6 | 無——藍 | 10.0 | 0.1%的90%乙醇溶液 | 1~2 |
有許多植物色素在不同pH值的溶液里會呈現出不同的顏色。因此,每個地方都可以就地取材,自製一些酸鹼指示劑。下面介紹一些自製的方法:
1.從紅蘿蔔皮中提取酸鹼指示劑:刮下紅蘿蔔的紅皮后,用95%的酒精浸泡一天左右,過濾取出它的濾液即酸鹼指示劑。按檢驗的需要製作pH1~14的標準液若干個,每個標準液取10ml分置於試管中,再分別加入紅蘿蔔皮浸泡液10滴,塞緊作為比色樣品。在某待測溶液中加入紅蘿蔔浸泡液,顏色發生變化后再與比色樣品比較,就能確定待測溶液pH值的大致範圍。
鹼指示劑應該選用甲基橙作指示劑。
4. 從米莧菜中提取酸鹼指示劑:其操作方法同操作3。
5.用咖喱粉制酸鹼指示劑:取一葯匙咖喱粉,用50%的調成糊狀,塗在一塊白布的兩面上,放置一段時間後用水衝去多餘的咖喱粉,白布被染成黃色,這就製成一塊可以多次反覆使用的酸鹼指示布。它遇鹼性溶液時呈紅色,遇酸性溶液時呈黃褐色。每次用完后,用水把布上的酸性或鹼性物質漂洗乾淨,指示布又恢復原來的黃色。可以供下次繼續使用。
還有很多植物的色素如月季花、菊花、牽牛花等的浸出液都可以製成不同的酸鹼指示劑。
