鹼金屬
在元素周期表中ⅠA族除氫外的六個金屬元素
鹼金屬是指在元素周期表中ⅠA族除氫(H)外的六個金屬元素,即鋰(Li)、鈉(Na)、鉀(K)、銣(Rb)、銫(Cs)、鈁(Fr)。
根據IUPAC的規定,鹼金屬屬於元素周期表中的ⅠA族元素。鹼金屬均有一個屬於s軌道的最外層電子,因此這一族屬於元素周期表的s區。鹼金屬的化學性質顯示出十分明顯的同系行為,是元素周期性 的最好例子。氫(H)雖然屬於ⅠA族,但顯現的化學性質和鹼金屬相差甚遠,因此不被認為是鹼金屬。
下表為鹼金屬元素在地殼中(不含海洋、大氣)的質量克拉克值,取自《無機化學(第五版)》,2008
.371
| 元素 | 鋰 | 鈉 | 鉀 | 銣 | 銫 |
| w(%) | 0.006% | 2.64% | 2.60% | 0.03% | 0.0006% |
由表可見,鹼金屬中,鉀、鈉的丰度較大,為常量元素,鋰、銣、銫丰度很小,為微量元素。而海水中,鈉的質量克拉克為1.062%,鉀的質量克拉克為0.038%,鉀、鈉同樣是海水中的常量元素。
礦物學
鹼金屬在自然界的礦物是多種多樣的,常見的如下
鈉:食鹽(氯化鈉)、天然鹼(碳酸鈉)、芒硝(十水硫酸鈉)、智利硝石(硝酸鈉)
鉀:硝石(硝酸鉀)、鉀石鹽(氯化鉀)、光鹵石、鉀鎂礬、明礬石(十二水硫酸鋁鉀)
銣:紅雲母、銣銫礦
銫:銣銫礦、銫榴石
鹼金屬在人體中以離子形式存在於體液中,也參與蛋白質的形成。
鹼金屬在人體中的質量分數(%)數據來源:《無機化學(第五版)》,2008.371
| 元素 | 鋰 | 鈉 | 鉀 | 銣 | 銫 |
| 鮮重 | 極微量 | 0.15% | 0.35% | 極微量 | — |
註:數據可能存在較大差異,以下數據可供核對:氧65%、碳18%、氫10%
人體中元素與地殼元素丰度呈正相關,這是生物鏈的傳遞結果。動物胚胎中鉀與鈉的質量分數相近,有學者認為這是動物源於海生有機體的證據之一。
·鋰離子:鋰在人腦有特殊作用,研究表明,鋰離子可以引起腎上腺素及神經末梢的胺量降低,能明顯影響神經遞質的量,因為鋰離子具體的作用機理尚不清楚,故鋰中毒也沒有特效解藥,但碳酸鋰目前被廣泛用於狂躁型抑鬱症的治療(口服:600mg~800mg╱天)。
·鈉離子:人體液的滲透壓平衡主要通過鈉離子和氯離子進行調節,鈉離子的另一個重要作用是調節神經元軸突膜內外的電荷,鈉離子與鉀離子的濃度差變化是神經衝動傳遞的物質基礎,世界衛生組織建議每人每日攝入(1~2)克鈉鹽,中國營養學會建議不要超過5克。
·鉀離子:鉀也參與調節滲透壓與軸突膜內外的電荷,人體中心臟、肝臟、脾臟等器官中鉀比較富集。
·銣元素:銣元素的生理作用還在研究中,有多種跡象表明銣與生命過程有關,疑似為微量元素。
鹼金屬在自然界的礦物是多種多樣的,常見的如下
鋰:鋰輝石、鋰雲母、透鋰長石
鈉:食鹽(氯化鈉)、天然鹼(碳酸鈉)、芒硝(十水硫酸鈉)、智利硝石(硝酸鈉)
鉀:硝石(硝酸鉀)、鉀石鹽(氯化鉀)、光鹵石、鉀鎂礬、明礬石(十二水硫酸鋁鉀)
銣:紅雲母、銣銫礦
銫:銣銫礦、銫榴石
| 元素 | 3 Li(鋰) | 11Na (鈉) | 19K(鉀) | 37Rb(銣) | 55Cs(銫) | 87Fr(鈁) |
| 熔點/℃ | 180.5 | 97.81 | 63.65 | 38.89 | 28.84 | 27 |
| 沸點/℃ | 1347 | 822.9 | 774 | 688 | 678.4 | 677 |
| 熔沸點變化 | 降低趨勢 | |||||
| 密度(25℃)/g·cm^-3 | 0.534 | 0.971 | 0.856 | 1.532 | 1.8785 | 1.870 |
| 密度變化 | 升高趨勢 | 反常 | ||||
| 導電性 | 導 體 | 導 體 | 導 體 | 導 體 | 導 體 | 導 體 |
| 顏 色 | 銀白色 | 銀白色 | 銀白色 | 銀白色 | 略帶黃色 | 紅色 |
| 形 態 | 固 體 | 固 體 | 固 體 | 固 體 | 固 體 | 固 體 |
| 金屬or非金屬性 | 金屬性 | 金屬性 | 金屬性 | 金屬性 | 金屬性 | 金屬性 |
| 價 態 | +1 | +1 | +1 | +1 | +1 | +1 |
| 主要氧化物 | Li2O | Na2O Na2O2 | K2O K2O2 | 複雜 | 複雜 | 複雜 |
| 氧化物對應的水化物 | LiOH | NaOH | KOH | RbOH | CsOH | FrOH |
| 氣態氫化物 | LiH | NaH | KH | RbH | CsH | FrH |
| 氣態氫化物的穩定性 | 不穩定 | 不穩定 | 不穩定 | 不穩定 | 不穩定 | 不穩定 |
| 硬度 | 逐漸減小(注意保存方式) | |||||
主條目:元素周期律
鹼金屬位於ⅠA族,其周期律性質主要表現為
·自上而下,鹼金屬元素的金屬性逐漸增強(元素金屬性強弱可以從其單質與水或酸反應置換出氫的難易程度,或它們的最高價氧化物的水化物——氫氧化物的鹼性強弱來推斷
)
·每一種鹼金屬元素都是同周期元素中金屬性最強的元素
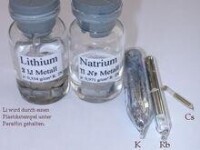
鹼金屬元素單質
與水反應
2Li+2H2O==2LiOH+H2(g)
2Na+2H2O==2NaOH+H2(g)
2K+2H2O==2KOH+H2(g)
與氧氣反應
4Li(s)+O₂(g)==2Li2O(s)
4Na(s)+O₂(g)==2Na2O(s)
2Na(s)+O₂(g)=△=Na2O₂(s)
R(s)+O₂(g)==RO2(s)R=K、Rb、Cs
與鹵素(X)反應
2R(s)+X₂(g)==2RX(s)
與氫氣(H₂)反應
2R(s)+H₂(g)=高溫=2RH(s)
與硫反應
2R(s)+S(s)==R2S(s),反應爆炸
與磷反應
3R(s)+P(s)==R3P(s)
鋰與氮氣反應
6Li(s)+N2(s)==2Li3N(s)
鹼金屬離子及其揮發性化合物在無色火焰中燃燒時會顯現出獨特的顏色,這可以用來鑒定鹼金屬離子的存在,鋰、銣、銫也是這樣被化學家發現的,電子躍遷可以解釋焰色反應,鹼金屬離子的吸收光譜落在可見光區,因而出現了標誌性顏色。
除了鑒定外,焰色反應還可以用於製造焰火和信號彈。
下表給出鹼金屬離子的焰色反應相關表格,波長數據取自《無機化學(第五版)》,2008
380
| 類別 | 鋰 | 鈉 | 鉀 | 銣 | 銫 |
| 顏色 | 紫紅 | 黃 | 淡紫 | 紫 | 藍 |
| 波長/nm | 670.8 | 589.2 | 766.5 | 780.0 | 455.5 |
鹼金屬離子及其揮發性化合物在無色火焰中燃燒時會顯現出獨特的顏色,這可以用來鑒定鹼金屬離子的存在,鋰、銣、銫也是這樣被化學家發現的,電子躍遷可以解釋焰色反應,鹼金屬離子的吸收光譜落在可見光區,因而出現了標誌性顏色。
除了鑒定外,焰色反應還可以用於製造焰火和信號彈。
下表給出鹼金屬離子的焰色反應相關表格,波長數據取自《無機化學(第五版)》,2008380
| 類別 | 鋰 | 鈉 | 鉀 | 銣 | 銫 |
| 顏色 | 紫紅 | 黃 | 淡紫 | 紫 | 藍 |
| 波長/nm | 670.8 | 589.2 | 766.5 | 780.0 | 455.5 |
鹼金屬的相關熱力學及電化學數據見下
數據取自《無機化學(第五版)》,2008
.375
電子親和能數據取自《化學-物質結構與性質(選修)》,2007年
.24
單位均為標準單位
| 類別 | 鋰 | 鈉 | 鉀 | 銣 | 銫 |
| 標準摩爾升華焓 | 159.37 | 107.32 | 89.24 | 80.88 | 76.065 |
| 標準摩爾水合焓 | -535.27 | -420.48 | -337.64 | -312.27 | -287.24 |
| 離子標準摩爾生成焓(aq) | 150.51 | 188.88 | 176.62 | 177.83 | 170.72 |
| 第一電離能(I) | 526.41 | 502.04 | 425.02 | 409.22 | 381.90 |
| 電子親和能(E) | 59.6 | 52.9 | 48.4 | 46.9 | 45.5 |
| 標準電極電勢E⊕ | -3.040 | -2.714 | -2.936 | -2.943 | -3.027 |
由表中可以看出鹼金屬的標準電極電勢都在-3.000V左右,表明其單質很容易失去電子,電離能不斷增加,電子親和能不斷遞減,表明其單質的還原性不斷增強,鋰的標準摩爾水合焓最大,但事實上鋰與水最不易反應,這是因為鋰的標準摩爾升華焓太大,且鋰與水的反應產物氫氧化鋰不溶於水,復蓋在鋰上,影響了反應。
ⅠA族的周期性十分明顯,但鋰還是和同族的其它鹼金屬元素有很大不同,這種不同主要表現在鋰化合物的共價性,這是由鋰的原子半徑過小導致的。
元素周期表中,鹼金屬鋰與位於其對角線位置的鹼土金屬鎂()存在一定的相似性,這裡體現了元素周期表中局部存在的“對角線規則”。鋰與鎂的相似性表現在:
·單質與氧氣作用生成正常氧化物
·單質可以與氮氣直接化合(和鋰同族的其它鹼金屬單質無此性質)
·氫氧化物為中強鹼,溶解度小,加熱易分解
·氟化物、碳酸鹽、磷酸鹽難溶於水
·碳酸鹽受熱易分解
究其原因,鋰-鎂對角線規則可以用周期表中離子半徑的變化來說明,同一周期從左到右,離子半徑因有效電荷的增加而減少,同族元素自上而下離子半徑因電子層數的增加而增大,鋰與鎂因為處於對角線處,鎂正好在鋰的“右下方”,其離子半徑因周期的遞變規律而減小,又因族的遞變規律而增大,二者抵消后就出現了相似性。
在鹼金屬元素形成的各類化合物中,鹼金屬陽離子是沒有特別性質的,鹼金屬化合物的性質在絕大多數情況下體現為陰離子的性質。
鹼金屬的鹽類大多為離子晶體,而且大部分可溶於水,其中不溶的鹽類有
·鋰鹽:氟化鋰、碳酸鋰、磷酸鋰
·鈉鹽:醋酸鈾醯鋅鈉、六羥基合錫(Ⅳ)酸鈉
、三鈦酸鈉、鉍酸鈉、六羥基合銻酸鈉
·鉀鹽:六硝基合鈷酸鉀鈉、高氯酸鉀、四苯基硼酸鉀
、高錸酸鉀
·銣鹽及銫鹽:與鉀鹽一樣,但溶解度更小。
鹼金屬的鹽類熔沸點較高,下表即為鹼金屬鹽類的熔點,本表取自《無機化學(第五版)》,2008
.387
單位:m.p./℃
| 鋰 | 鈉 | 鉀 | 銣 | 銫 | |
| 氯化物 | 613 | 801 | 771 | 715 | 646 |
| 硫酸鹽 | 859 | 880 | 1069 | 1050 | 1005 |
| 硝酸鹽 | ~225 | 307 | 333 | 305 | 414 |
| 碳酸鹽 | 720 | 858 | 901 | 837 | 792 |
從表中還可以觀察到:鋰鹽的沸點明顯偏低,表明鋰鹽表現出一定的共價性
鹵化物
陽極:2Cl--2e- ——→Cl₂↑
陰極:2H++2e- ——→H₂↑
總反應:2NaCl+2H2O——電解→2NaOH+H₂↑+Cl₂↑
硫酸鹽
鹼金屬硫酸鹽中以硫酸鈉最為常見,十水合硫酸鈉俗稱芒硝,用於相變儲熱,無水硫酸鈉俗稱元明粉,用於玻璃、陶瓷工業及製取其它鹽類。
鹼金屬的硝酸鹽在加強熱時分解為亞硝酸鹽
2MNO₃(s)——→2MNO₂(s)+O₂(g)
硝酸鉀(KNO₃)和硝酸鈉(NaNO₃)是常見的硝酸鹽,可用作氧化劑
碳酸鹽
鹼金屬的碳酸鹽中,碳酸鋰可由含鋰礦物與碳酸鈉反應得到,是製取其它鋰鹽的原料,還可用於狂躁型抑鬱症的治療;碳酸鈉俗名純鹼,是重要的工業原料,主要由侯氏制鹼法生產。
NH₃(g)+H2O(l)+CO₂(g)——→NH4HCO₃(aq)
NH4HCO₃(aq)+NaCl(s)——→NH4Cl(aq)+NaHCO₃(s)
2NaHCO₃(s)—△→Na2CO₃(s)+H2O(l)+CO₂↑(g)
鹼金屬的有機金屬化合物在有機合成上有重要應用,以下對常見物種簡要介紹其中
烴(烷)基鋰
烴基鋰中存在橋鍵(LI-C-Li),以四聚體的形式存在,烴基鋰中碳-鋰鍵具有共價鍵的特徵,其中丁基鋰具有揮發性,並能進行減壓蒸餾就是一個例子。
烴基鋰是強親核試劑,親核能力優於格氏試劑,能引發後者的所有加成反應,並有更高的產率,但立體選擇性差;烴基鋰位阻小,反應時受空間效應的影響小,因此可用烴基鋰合成位阻較大的醇,此外,烴基鋰與銅(Ⅰ)鹵化物可形成二烴基銅鋰,在有機合成上也有重要應用。烴基鋰容易與水反應,製備時要徹底乾燥。
炔基鈉
1-炔烴可與鈉在液氨中生成炔基鈉,炔基鈉是親核試劑,可與鹵代烴反應備制炔的衍生物或增長碳鏈,此外,也可以與醯鹵反應備制炔基酮,但在有機合成中應用較少,其替代品為炔基銅(Ⅰ)化合物。
鹼金屬單質與氧氣能生成各種複雜的氧化物
正常氧化物
鹼金屬中,只有鋰可以直接生成氧化物,其它鹼金屬單質的氧化物可以被繼續氧化
4Li(s)+O₂(g)——→2Li2O(s)
鹼金屬的正常氧化物是反磁性物質,都能與水反應生成對應的氫氧化物
M2O(s)+H2O(l)——→MOH(aq)
鹼金屬正常氧化物的相關性質見下,取自《無機化學(第五版)》,2008
.383
單位均為標準熱力學單位
| 類別 | 氧化鋰 | 氧化鈉 | 氧化鉀 | 氧化銣 | 氧化銫 |
| 顏色 | 白 | 白 | 淡黃 | 亮黃 | 橙紅 |
| 熔點/K | 1743.15 | 1093.15 | ~523.15(分解) | ~573.15(分解) | ~663.15(分解) |
| 標準摩爾生成焓 | -597.9 | -414.22 | -361.5 | -339 | -345.77 |
過氧化物
所有鹼金屬都能形成過氧化物,除鋰外,其它鹼金屬可以直接化合得到過氧化物,鹼金屬的過氧化物呈淡黃色
2M(s)+O₂(g)——→M2O₂(s)
過氧化物中的氧元素以過氧陰離子的形式存在,過氧根離子的鍵級為1。過氧化物是強鹼(質子鹼),能與水反應生成鹼性更弱的氫氧化物和過氧化氫,由於反應大量放熱,生成的過氧化氫會迅速分解產生氧氣。
2M2O₂(s)+2H2O(l)——→4MOH(aq)+O₂(aq)
2H2O₂(aq)——→2H2O(l)+O₂(g)
過氧化物可與酸性氧化物反應生成對應的正鹽,若與之反應的酸性氧化物有較強還原性,則有被氧化的可能
2M2O₂(s)+2CO₂(g)——→2M2CO₃(s)+O₂(g)
M2O₂(s)+SO₂(g)——→2M2SO₄(s)
過氧化物在熔融狀態下可與某些鉑系元素形成含氧酸鹽
Ru(s)+3M2O₂(l)——→M2RuO₄(s)+2M2O(l)
過氧化物中常見的是過氧化鈉(Na2O₂)和過氧化鉀(K2O₂),它們可用於漂白,熔礦,生氧。
超氧化物
除鋰外,所有鹼金屬元素都有對應的超氧化物,鉀、銣、銫能在空氣中直接化合得到超氧化物,超氧化鉀為淡黃~橙黃色,超氧化銣為棕色,超氧化銫為深黃色。
M(s)+O₂(g)——→MO₂(s)
超氧化物能與水反應生成對應氫氧化物,氧氣和過氧化氫,反應大量放熱,過氧化氫分解
2MO₂(s)+2H2O(l)——→2MOH(aq)+H2O₂(l)+O₂(g)
2H2O₂(aq)——→2H2O(l)+O₂(g)
超氧化物能與酸性氧化物反應,類似過氧化物,其中,超氧化鉀與二氧化碳的反應被應用於急救空氣背包中
4MO₂(s)+2CO₂(g)——→2M2CO₃(s)+3O₂(g)
超氧化鉀是最為常見的超氧化物
臭氧化物
除鋰外,乾燥的鹼金屬氫氧化物固體與臭氧(O₃)反應,產物在液氨中重結晶可得到臭氧化物晶體
6MOH(s)+4O₃(g)——→4MO₃(s)+2MOH·H2O(s)+O₂(g)
臭氧化物在放置過程中緩慢分解
2MO₃(s)——→2MO₂(s)+O₂(g)
臭氧化物中存在臭氧離子,V型結構,鍵級為1/3,極不穩定,具有順磁性
臭氧化物的其他性質與超氧化物類似,不再贅述。
鹼金屬單質在氫氣流中加熱就可獲得對應的氫化物
2M(s)+H₂(g)——→2MH(s)
鹼金屬氫化物中以氫化鋰(LiH)最為穩定,850℃分解
鹼金屬氫化物與水劇烈反應放出氫氣
MH(s)+H2O(l)——→MOH(aq)+H₂(g)
鹼金屬元素的氫氧化物常溫下為白色固體,可溶或易溶於水,溶於水放出大量熱,在空氣中會發生潮解並吸收酸性氣體;除氫氧化鋰外其餘的鹼金屬氫氧化物都屬於強鹼,在水中完全電離。
2MOH(s)+CO₂(g)——→M2CO₃(s)+H2O(l)
2MOH(aq)+2Al(s)+2H2O(l)——→2MAlO₂(aq)+3H₂(g)
2MOH(aq)+Al2O₃(s)——→2MAlO₂(aq)+H2O(l)
3MOH(aq)+FeCl₃(aq)——→Fe(OH)₃(s)+3MCl(l)
鹼金屬氫氧化物中以氫氧化鈉和氫氧化鉀最為常見,可用作乾燥劑。
冠醚的中央存在一個特定大小的空腔,可與鹼金屬離子絡合形成絡合物,常見的有
鋰離子:12-冠-4
鈉離子:15-冠-5
鉀離子:18-冠-6
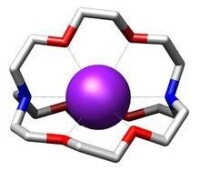
鉀離子與&
鉀離子:[2.2.2]穴醚
應用
·表面活性劑(surfactant)
·相轉移催化劑(Phase transfer catatysisPTC)
·分離對應的鹼金屬離子
