共找到2條詞條名為鹵代烴的結果 展開
- 化合物
- 鹵烴
鹵代烴
化合物
烴分子中的氫原子被鹵素原子取代后的化合物稱為鹵代烴(Haloalkane),簡稱鹵烴。鹵代烴的通式為:(Ar)R-X,X可看作是鹵代烴的官能團,包括F、Cl、Br、I。鹵代烴能與某些金屬作用,生成金屬有機化合物,例如與鋰、鎂等反應,生成有機鋰、有機鎂化合物,它們都是有機合成中極重要的試劑,其中鎂試劑稱為格利雅試劑:.鹵代烴與醇鈉作用,鹵原子被烷氧基(RO—)取代生成醚,這是製取混合醚的方法。鹵代烴與氰化鈉(或氰化鉀)的醇溶液共熱,鹵原子被氰基取代生成腈。
鹵代烴的通式為:(Ar)R-X,X可看作是鹵代烴的官能團,包括F、Cl、Br、I。
根據取代鹵素的不同,分別稱為氟代烴、氯代烴、溴代烴和碘代烴;也可根據分子中鹵素原子的多少分為一鹵代烴、二鹵代烴和多鹵代烴;也可根據烴基的不同分為飽和鹵代烴、不飽和鹵代烴和芳香鹵代烴等。此外,還可根據與鹵原子直接相連碳原子的不同,分為一級鹵代烴RCH2X、二級鹵代烴R2CHX和三級鹵代烴R3CX。
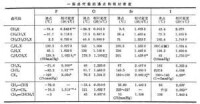
物理性質基本上與烴相似。低級的是氣體或液體,高級的是固體。它們的沸點隨分子中碳原子和鹵素原子數目的增加(氟代烴除外)和鹵素原子序數的增大而升高。一氟代烴和一氯代烴一般比水輕,溴代烴、碘代烴及多鹵代烴比水重。一些鹵代烴的沸點和相對密度見表。絕大多數鹵代烴不溶於水或在水中溶解度很小,但它們能溶於很多有機溶劑,有些可以直接作為溶劑使用。鹵代烴大都具有一種特殊氣味,多鹵代烴一般都難燃或不燃。
鹵代烴
或H
NR取代,生成相應的醇、醚、腈、胺等化合物,一般反應式可寫為:
R─X+:Nu─→R─Nu+:X
碘代烷最容易發生取代反應,溴代烷次之,氯代烷又次之,芳基和乙烯基鹵代物由於碳-鹵鍵連接較為牢固,很難發生類似反應。
鹵代烴可以發生消去反應,在鹼的醇溶液中的作用下脫去鹵化氫生成碳-碳雙鍵或碳-碳叄鍵:
如:溴乙烷在氫氧化鈉的醇溶液中發生消去反應,生成乙烯氣體和溴化鈉和水。
鄰二鹵化合物除可以進行脫鹵化氫的反應外,在鋅粉(或鎳粉)作用下還可發生脫鹵反應生成烯烴。此外,某些鹵代烴在強鹼的作用下,能夠發生
-消除,從而產生卡賓。例如,氯仿與叔丁醇鉀反應,產生二氯卡賓等:
簡單的鹵代烴,如氯(代)甲烷、二氯甲烷等,多是在高溫或光照條件下由烷烴直接發生取代反應製得。結構複雜的鹵代烴則多由相應的醇或不飽和烴製得。
對於一鹵代烴而言,通常用醇、烴來製取:
(1)由醇製取:是普遍採用的經典方法。常用的試劑有氫鹵酸、鹵化磷及氯化亞碸(SOCl,或稱亞硫醯氯)。
A.醇與氫鹵酸作用:
ROH+HX®RX+HO
這是一個可逆反應。為了使反應完全,設法從反應中不斷地移去水,可以提高產率,例如在製備氯代烴時,採用乾燥氯化氫氣體在無水氯化鋅存在下通入醇中;製備溴代烴時,是將溴化鈉與濃硫酸的混合物與醇共熱;製備碘代烴時,將醇與氫碘酸一起迴流。值得一提的是,這並不是一種合成鹵烴的好方法。主要是因為有些醇在反應過程中會發生重排,生成混合產物。
B.醇與鹵化磷作用。醇與鹵化磷作用,可以製備氯代烴、溴代烴和碘代烴。製備溴代烴或碘代烴常用三溴化磷或三碘化磷。例如:
3CHOH+PBr®3CHBr+P(OH)
3CHOH+PI®3CHI+P(OH)
所用的三鹵化磷是用赤磷和溴或碘直接加入醇中反應。
製備氯代烴一般不採用三氯化磷,常因生成亞磷酸酯而使產率只能達到50%左右:
3ROH+PCl®P(OR)+3HCl
所以,一般採用五氯化磷與醇反應製取氯代烴。
ROH+PCl5®RCl+POCl+HCl
C.醇與氯化亞碸(SOCl)作用。這是製備氯代烴最常用的方法之一。
ROH+SOCl®RCl+SO+HCl
反應生成的副產物都是氣體,容易除去,故產品純度高,產率可達90%左右。工業生產也多採用此法。
(2)用烴製備
A.飽和烴發生取代反應:CH + Cl ® CHCl + HCl
B.不飽和烴發生加成反應:CH=CH + HBr ® CHCHBr
由於鹵素原子吸引電子的能力大,致使鹵代烴分子中的C—X鍵具有一定的極性。當C—X鍵遇到其他的極性試劑時,鹵素原子被其他原子或原子團取代。
(1)被羥基取代
鹵代烴與水作用可生成醇。在反應中,鹵代烴分子中的鹵原子被水分子中的羥基所取代:
R—X+HOHR—OH+HX
該反應進行比較緩慢,而且是可逆的。如果用強鹼的水溶液來進行水解,這個反應可向右進行,原因是在反應中產生的鹵化氫被鹼中和掉,而有利於反應向水解方向進行。
R—X+NaOHR—OH+NaX
鹵素與苯環相連的鹵代芳烴,一般比較難水解。如氯苯一般需要高溫高壓條件下才能水解。
(2)被烷氧基取代
鹵代烴與醇鈉作用,鹵原子被烷氧基(RO—)取代生成醚,這是製取混合醚的方法。
RX+R′ONa—→ROR′+NaX
例:CH3Br+CH3CH3ONa—→CH3—O—CH2CH3(甲乙醚)+NaBr
(3)被氰基取代
鹵代烴與氰化鈉(或氰化鉀)的醇溶液共熱,鹵原子被氰基取代生成腈。
RX+NaCNRCN+NaX
生成的腈分子比原來的鹵代烴分子增加了一個碳原子,這在有機合成中作為增長碳鏈的一種方法。
消除反應
鹵代烷在鹼的醇溶液中加熱,可脫去一個鹵化氫分子,形成烯烴。
RCH2CH2X+KOH—→RCH=CH2+KX+H2O
與金屬作用
鹵代烴能與多種金屬作用,生成金屬有機化合物,其中格氏試劑是金屬有機化合物中最重要的一類化合物,是有機合成中非常重要的試劑之一。它是鹵代烷在無水乙醚中與金屬鎂作用,生成的有機鎂化合物,再與活潑的鹵代烴如丙烯型、苯甲型鹵代烴偶合,形成烴。
RX+MgRMgX
CH2=CHCH2Cl+RMgCl—→CH2=CHCH2R+MgCl2
C6H5CH2Cl+CH2=CH—CH2MgCl—→C6H5CH2CH2CH=CH2+MgCl2
鹵代烷與金屬鈉作用可生成烷烴,利用這個反應可以製備高級烷烴。
2RBr+2Na—→R—R+2NaBr

重要的鹵代烴—氟利昂
在有機合成上,由於鹵代烴的化學性質比較活潑,能發生許多反應,例如取代反應、消去反應等,從而轉化成其他類型的化合物。因此,引入鹵原子常常是改變分子性能的第一步反應,在有機合成中起著重要的橋樑作用。如:
1、在烴分子中引入羥基。例如由苯制苯酚。先用苯與氯氣在有鐵屑存在的條件下發生取代反應製取氯苯,在用氯苯在氫氧化鈉存在的條件下與高溫水蒸氣發生水解反應便得到苯酚;再例如由乙烯制乙二醇。先用乙烯與氯氣發生加成反應制1,2-二氯乙烷,再用1,2-二氯乙烷再氫氧化鈉溶液中發生水解反應製得乙二醇。
2、在特定碳原子上引入鹵原子。例如,由1-溴丁烷制1,2-二溴丁烷。先由1-溴丁烷發生消去反應得1-丁烯,再由1-丁烯與溴加成得1,2-二溴丁烷。
3、改變某些官能團的位置。例如,由1-丁烯制2-丁烯。先由1-丁烯與氯化氫加成得2-氯丁烷,再由2-氯丁烷發生消去反應得2-丁烯;如由
1-溴丙烷制2-溴丙烷。先由1-溴丙烷通過消去反應制丙烯,再由丙烯與溴化氫加成得2-溴丙烷;由1-丙醇制2-丙醇。先由1-丙醇消去反應制丙烯,再由丙烯與氯化氫加成制2-氯丙烷,最後由2-氯丙烷水解得2-丙醇。
4、與溴乙烷相似。
(1).水解反應。
(2).消去反應。
毒性鹵素是強毒性基,鹵代烴一般比母體烴類的毒性大。鹵代烴經皮膚吸收后,侵犯神經中樞或作用於內臟器官,引起中毒。一般來說,碘代烴毒性最大,溴代烴、氯代烴、氟代烴毒性依次降低。低級鹵代烴比高級鹵代烴毒性強;飽和鹵代烴比不飽和鹵代烴毒性強;多鹵代烴比含鹵素少的鹵代烴毒性強。使用鹵代烴的工作場所應保持良好的通風。
(1)輕度中毒:接觸低濃度氯丁二烯,可引起強烈的刺激癥狀,出現眼結膜充血、流淚、咳嗽、胸痛,以及頭痛、頭暈、嗜睡、噁心、嘔吐等癥狀。
(2)重度中毒:吸入高濃度氯丁二烯,可引起嚴重嘔吐、煩躁不安、興奮、抽搐、血壓下降、肺水腫、休克。嚴重者迅速陷入昏迷。
(3)長期接觸可致毛髮脫落,發生接觸性皮炎,結膜炎,角膜周邊性壞死以及貧血和腎臟損害。實驗室檢查:血中谷胱甘肽(GSH)明顯減少可作診斷中毒的參考。另尿中可出現蛋白質,外周血紅細胞、白細胞、血小板可下降,網織紅細胞增多。
1.迅速移離中毒場所,清洗污染的皮膚。
2.吸氧。
3.必要時,給予呼吸興奮劑,呼吸停止者應立即口對口人工呼吸。
4.以10%硫代硫酸鈉10ml靜脈注射。
5.及時防治肺水腫及保肝治療。重視對症治療。
①將鹵代烴與過量NaOH溶液混合(加熱),充分振蕩、靜置;
②然後再向混合溶液中加入過量的稀HNO3以中和過量的NaOH;
③最後,向混合液中加入AgNO3溶液,若有白色沉澱生成則證明是氯代烴;若有淺黃色沉澱生成,則證明是溴代烴;若有黃色沉澱生成,則證明是碘代烴。

重要的鹵代烴—氟利昂
