乙烯
兩個碳原子和四個氫原子組成的化合物
乙烯是由兩個碳原子和四個氫原子組成的化合物。兩個碳原子之間以雙鍵連接。乙烯存在於植物的某些組織、器官中,是由蛋氨酸在供氧充足的條件下轉化而成的。
乙烯是合成纖維、合成橡膠、合成塑料(聚乙烯及聚氯乙烯)、合成乙醇(酒精)的基本化工原料,也用於製造氯乙烯、苯乙烯、環氧乙烷、醋酸、乙醛、乙醇和炸藥等,尚可用作水果和蔬菜的催熟劑,是一種已證實的植物激素。
乙烯是世界上產量最大的化學產品之一,乙烯工業是石油化工產業的核心,乙烯產品占石化產品的75%以上,在國民經濟中佔有重要的地位。世界上已將乙烯產量作為衡量一個國家石油化工發展水平的重要標誌之一。
生理作用是:三重反應、促進果實成熟、促進葉片衰老、誘導不定根和根毛髮生、打破植物種子和芽的休眠、抑制許多植物開花(但能誘導、促進菠蘿及其同屬植物開花)、在雌雄異花同株植物中可以在花發育早期改變花的性別分化方向等。
2017年10月27日,世界衛生組織國際癌症研究機構公布的致癌物清單初步整理參考,乙烯在3類致癌物清單中。
中國古代就發現將果實放在燃燒香燭的房子里可以促進採摘果實的成熟。19世紀德國人發現在泄露的煤氣管道旁的樹葉容易脫落。第一個發現植物材料能產生一種氣體,並對鄰近植物能產生影響的是卡曾斯,他發現橘子產生的氣體能催熟與其混裝在一起的香蕉。直到1934年甘恩(Gane)才首先證明植物組織確實能產生乙烯。隨著氣相色譜技術的應用,使乙烯的生物化學和生理學研究方面取得了許多成果,並證明在高等植物的各個部位都能產生乙烯,1966年乙烯被正式確定為植物激素。
隨著中國經濟的快速發展,中產階級生活水平得到了很大的提升,中國對乙烯衍生物市場終端產品的需求在快速增長;印度的市場需求也在同步增長,但基數相對較小。2010年,東北亞地區將成為世界乙烯需求量最大的地區,佔全球乙烯市場需求比例由2000年的21%增長到35%;預計2014年中國乙烯需求將佔世界總需求的36%。
資料顯示,雖然我國乙烯行業發展迅猛,在世界乙烯市場佔有舉足輕重的地位,但依然有些不可規避的風險存在。
首先,市場競爭風險。中東乙烯企業主要以乙烷為原料生產乙烯,該地區的乙烷成本很低,即使加上運費,也比美國、西歐和世界其他地區包括中國的成本低得多,具有相當強的競爭力。廉價的中東乙烯下游產品聚乙烯、乙二醇等大量湧入亞太和中國市場,必將對我國市場相關產品構成嚴重的威脅。
其次,環境保護風險。乙烯工業生產過程中存在一定程度的環境污染問題,但在當今的環保技術下,乙烯的生產會對大氣、水體造成一定程度的污染。隨著新建項目的陸續投產以及中國政府在未來出台更為嚴格的環保標準,將對乙烯企業的環保工作提出更高的要求,企業存在因增加環保治理費用而使經營成本上升的風險。
此外還有石油進口的風險。乙烯裝置的大量建設,也加大了對化工用油的需求。與中國面臨著石油短缺制約一樣,國內發展石化工業也面臨著資源制約矛盾,而國內原油產量一直在2億噸左右,遠低於石油需求的增長速度。隨著今後乙烯工業的發展,化工用油短缺的矛盾也將日益突出。
分子式:CH
結構簡式::CH=CH
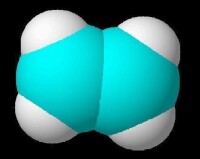
乙烯分子比例模型
乙烯有4個氫原子的約束,碳原子之間以雙鍵連接。所有6個原子組成的乙烯是共面。H-C-C角是121.3°;H-C-H角是117.4 °,接近120 °,為理想sp 2混成軌域。這種分子也比較僵硬:旋轉C=C鍵是一個高吸熱過程,需要打破π鍵,而保留σ鍵之間的碳原子。VSEPR模型為平面矩形 立體結構也是平面矩形。雙鍵是一個電子云密度較高的地區,因而大部分反應發生在這個位置。
通常情況下,乙烯是一種無色稍有氣味的氣體,密度為1.256g/L,比空氣的密度略小,難溶於水,易溶於四氯化碳等有機溶劑。
外觀與性狀:無色氣體,略具烴類特有的臭味。少量乙烯具有淡淡的甜味。
吸收峰:吸收帶在遠紫外區
pH:水溶液是中性
凝固點:-169.4℃
相對密度:0.00127
折射率:1.363
相對密度(水=1):0.61
相對蒸氣密度(空氣=1):0.99
飽和蒸氣壓(kPa):4083.40(0℃)
燃燒熱(kJ/mol):1411.0
臨界溫度(℃):9.2
臨界壓力(MPa):5.04
閃點(fp):無意義
引燃溫度(℃):425
爆炸上限%(V/V):36.95
爆炸下限%(V/V):2.74
溶解性:不溶於水,微溶於乙醇、酮、苯,溶於醚。溶於四氯化碳等有機溶劑。
①常溫下極易被氧化劑氧化。如將乙烯通入酸性KMnO4溶液,溶液的紫色褪去,乙烯被氧化為二氧化碳,由此可用鑒別乙烯。
②易燃燒,並放出熱量,燃燒時火焰明亮,併產生黑煙。
CH═CH+3O→2CO+2HO
③烯烴臭氧化:
CH=CH+O,在鋅保護下水解→2HCHO
CH=CH+(1/2)O— →CH3—CHO
加成反應
CH═CH+Br→CHBr—CHBr(常溫下使溴水褪色)
CH═CH+HCl— →CH—CHCl(制氯乙烷)
CH═CH+H20— →CHCHOH(制酒精)
CH═CH+H— →CHCH
CH═CH+Cl→CHCl—CHCl
加成反應:有機物分子中雙鍵(或三鍵)兩端的碳原子與其他原子或原子團直接結合生成新的化合物的反應。
nCH═CH→-[CH—CH]- (制聚乙烯)
在一定條件下,乙烯分子中不飽和的C═C雙鍵中的一個鍵會斷裂,分子里的碳原子能互相形成很長的鍵且相對分子質量很大(幾萬到幾十萬)的化合物,叫做聚乙烯,它是高分子化合物。
這種由相對分子質量較小的化合物(單體)相互結合成相對分子質量很大的化合物的反應,叫做聚合反應。這種聚合反應是由一種或多種不飽和化合物(單體)通過不飽和鍵相互加成而聚合成高分子化合物的反應,所以又屬於加成反應,簡稱加聚反應。
最簡單的烯烴。分子式CH=CH 。少量存在於植物體內,是植物的一種代謝產物,能使植物生長減慢,促進葉落和果實成熟。無色易燃氣體。熔點-1699℃,沸點-1039.8℃。幾乎不溶於水,難溶於乙醇,易溶於乙醚和丙酮。
乙烯分子里的C=C雙鍵的鍵長是1.33×10 -10 米,乙烯分子里的2個碳原子和4個氫原子都處在同一個平面上。它們彼此之間的鍵角約為120°。乙烯雙鍵的鍵能是615千焦/摩,實驗測得乙烷C—C單鍵的鍵長是1.54×10 -10 米,鍵能348千焦/摩。這表明C=C雙鍵的鍵能並不是C—C單鍵鍵能的兩倍,而是比兩倍略少。因此,只需要較少的能量,就能使雙鍵里的一個鍵斷裂。這是乙烯的性質活潑,容易發生加成反應等的原因。
在形成乙烯分子的過程中,每個碳原子以1個2s軌道和2個2p軌道雜化形成3個等同的sp 2 雜化軌道而成鍵。這3個sp 2 雜化軌道在同一平面里,互成120°夾角。因此,在乙烯分子里形成5個σ鍵,其中4個是C—H鍵(sp 2 — s)1個是C—C鍵(sp 2 — sp 2 );兩個碳原子剩下未參加雜化的2個平行的p軌道在側面發生重疊,形成另一種化學鍵:π鍵,並和σ鍵所在的平面垂直。如:乙烯分子里的C=C雙鍵是由一個σ鍵和一個π鍵形成的。這兩種鍵的軌道重疊程度是不同的。π鍵是由p軌道從側面重疊形成的,重疊程度比σ鍵從正面重疊要小,所以π鍵不如σ鍵牢固,比較容易斷裂,斷裂時需要的能量也較少。
乙烯是一種氣體激素。成熟的組織釋放乙烯較少,而在分生組織,萌發的種子、凋謝的花朵和成熟過程中的果實乙烯的產量較大。它存在於成熟的果實;莖的節;衰老的葉子中。乙烯的產生具有“自促作用”(即乙烯的積累可以刺激更多的乙烯產生)。
植物在乾旱、大氣污染、機械刺激、化學脅迫、病害等逆境下,體內乙烯成幾倍或幾十倍的增加,這種在逆境下由植物體產生的乙烯稱為應激乙烯或逆境乙烯(lstress ethylene)。
乙烯製取方程式
乙烯
實驗室里是把酒精和濃硫酸按1:3混合迅速加熱到170℃,使酒精分解製得。濃硫酸在反應過程里起催化劑和脫水劑的作用。方程式為:CHCHOH— 2 4 CH=CH↑+HO
製取乙烯的反應屬於液——液加熱型
乙烯的化學性質——加成反應
把乙烯通入盛溴水的試管里,可以觀察到溴水的紅棕色很快消失。
乙烯能跟溴水裡的溴起反應,生成無色的1,2-二溴乙烷(CHBr-CHBr)液體。
這個反應的實質是乙烯分子里的雙鍵里的一個鍵易於斷裂,兩個溴原子分別加在兩個價鍵不飽和的碳原子上,生成了二溴乙烷。這種有機物分子里不飽和碳原子跟其它原子或原子團直接結合生成別的物質的反應叫做加成反應。
乙烯還能跟氫氣、氯氣、鹵化氫以及水等在適宜的反應條件下起加成反應。
口訣:
硫酸乙醇三比一,溫計入液一百七。
迅速升溫防碳化,鹼灰除雜最適宜。
解釋:
1.硫酸乙醇三比一:意思是說在實驗室里是用濃硫酸和乙醇(按3:1的比例)在燒瓶中混合加熱的方法製取乙烯的。
2.溫計入液一百七:“溫計”指溫度計,“溫計入液”的意思是說溫度計的水銀球必須浸入混合液中(但不能接觸燒瓶底);“一百七”的意思是說此實驗的溫度必須控制在170℃左右。
3.迅速升溫防碳化:意思是說加熱時要將溫度迅速升到170℃,否則乙醇易被濃硫酸氧化而碳化。
4.鹼灰除雜最適宜:“鹼灰”指鹼石灰。意思是說通過鹼石灰可除掉混在乙烯中的水蒸氣和SO2。
用途:製造塑料、合成乙醇、乙醛、合成纖維等重要原料
乙烯ethylene CH=CH,為一種植物激素。由於具有促進果實成熟的作用,並在成熟前大量合成,所以認為它是成熟激素(ripening hormone)。可抑制莖和根的增粗生長、幼葉的伸展、芽的生長、花芽的形成;另一方面可促進莖和根的擴展生長、不定根和根毛的形成、某些種子的發芽、偏上生長、芽彎曲部的形成器官的老化或脫離等。能促進鳳梨的開花,促進水稻和水繁縷莖的生長。幾乎所有作用的有效氣中濃度的閾值為0.0—0.1微升/升,最大值為1—10微升/升。一部分菌類和大部分高等植物均可生成乙烯,而在成熟的果實里可大量的生成。若給營養組織以植物生長素或各種應力(接觸、病傷害、藥物處理等)則生成量可激增。在生物體內由甲硫氨酸生物合成,其第三、第四位碳轉變為乙烯,但合成酶的性質不明。甲硫氨酸脫氨生成的α-酮-4-甲硫丁酸,或後者進一步脫羧生成的甲硫丙醛,在過氧化氫、亞硫酸鹽、單酚的存在下由於過氧化物酶的作用而有效地生成乙烯,因此曾被認為是乙烯生物合成的中間體,但甲硫丙醛在生物體內存在尚未被證實。梅普森和沃德爾(L.Mapson.D.Wardale)在體外用轉氨酶、過氧化物酶和供給過氧化氫的葡萄糖氧化酶等三種酶的協同作用,顯示出由甲硫氨酸合成乙烯的事實,但通過同位素標記化合物的實驗,認為此反應系統在體內不起作用。乙烯也有從除甲硫氨酸以外的物質進行生物合成的情況。乙烯用量最大的是生產聚乙烯,約佔乙烯耗量的45%;其次是由乙烯生產的二氯乙烷和氯乙烯;乙烯氧化制環氧乙烷和乙二醇。另外乙烯烴化可制苯乙烯,乙烯氧化制乙醛、乙烯合成酒精、乙烯製取高級醇。
主要用途:
1.乙烯是重要的有機化工基本原料,主要用於生產聚乙烯、乙丙橡膠、聚氯乙烯等;
2.石油化工最基本的原料之一。在合成材料方面,大量用於生產聚乙烯、氯乙烯及聚氯乙烯,乙苯、苯乙烯及聚苯乙烯以及乙丙橡膠等;在有機合成方面,廣泛用於合成乙醇、環氧乙烷及乙二醇、乙醛、乙酸、丙醛、丙酸及其衍生物等多種基本有機合成原料;經鹵化,可制氯代乙烯、氯代乙烷、溴代乙烷;經齊聚可制α-烯烴,進而生產高級醇、烷基苯等;
3.主要用作石化企業分析儀器的標準氣;
4.乙烯用作臍橙、蜜桔、香蕉等水果的環保催熟氣體;
5.乙烯用於醫藥合成、高新材料合成。
乙烯“三重反應”(triple response of ethylene):①抑制莖的伸長生長;②促進莖和根的增粗;③促進莖的橫向增長。用乙烯處理黃化幼苗莖可使莖加粗和葉柄偏上生長。
由於乙烯可以促進RNA和蛋白質的合成,並可在高等植物體內使細胞膜的透性增加,加速呼吸作用,因而當果實中乙烯含量增加時,已合成的生長素又可被植物體內的酶或外界的光所分解,進一步促進其中有機物質的轉化,加速成熟。常用乙烯利溶液浸泡未完全成熟的番茄、蘋果、梨、香蕉、柿子等果實能顯著促進成熟。
乙烯也有促進器官脫落和衰老的作用。乙烯在花、葉和果實的脫落方面起著重要的作用。
乙烯還可誘導插枝不定根的形成,促進根的生長和分化,打破種子和芽的休眠,誘導次生物質的分泌等。

乙烯促進植物發育
乙烯是氣體,難於在田間應用,直到開發出乙烯利,才為農業提供可實用的乙烯類植物生長調節劑。主要產品有乙烯利、乙烯硅、乙二肟、甲氯硝吡唑、脫葉膦、環己醯亞胺(放線菌酮),它們都能釋放出乙烯,或促進植物產生乙烯的植物生長調節劑,所以統稱之為乙烯釋放劑。目前國內外最為常用的僅是乙烯利,廣泛應用於果實催熟、棉花採收前脫葉和促進棉鈴開裂吐絮、刺激橡膠乳汁分泌、水稻矮化、增加瓜類雌花及促進菠蘿開花等。
乙烯類植物生長調節劑中還有一些品種在植物體內通過抑制乙烯的合成,而達到調節植物生長的作用,則稱之為乙烯合成抑製劑。國內市場上尚無此類產品,因而不予介紹。
侵入途徑:吸入
健康危害:具有較強的麻醉作用。
急性中毒:吸入高濃度乙烯可立即引起意識喪失,無明顯的興奮期,但吸入新鮮空氣后,可很快蘇醒。對眼及呼吸道粘膜有輕微刺激性。液態乙烯可致皮膚凍傷。
慢性影響:長期接觸,可引起頭昏、全身不適、乏力、思維不集中。個別人有胃腸道功能紊亂。
環境危害:對環境有危害,對水體、土壤和大氣可造成污染。
燃爆危險:易燃。
S9保持容器置於良好通風處。 S16遠離火源。 S33採取措施,預防靜電發生。 S46若不慎吞食,立即求醫並出示其容器或標籤。
| 文獻、期刊報道的毒性作用試驗數據 | ||||
|---|---|---|---|---|
| 毒性類型 | 測試方法 | 測試對象 | 使用劑量 | 毒性作用 |
| 急性毒性 | 吸入 | 哺乳動物 | 95000000 ppm/5M | 詳細作用沒有報告除致死劑量以外的其他值 |
皮膚接觸:發生凍傷不要塗擦,不要使用熱水。使用清潔、乾燥的敷料包紮,就醫治療。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少30分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:飲足量溫水,催吐。就醫。
危險特性:易燃,與空氣混合能形成爆炸性混合物。遇明火、高熱或與氧化劑接觸,有引起燃燒爆炸的危險。與氟、氯等接觸會發生劇烈的化學反應。
有害燃燒產物:一氧化碳。
滅火方法:切斷氣源。若不能切斷氣源,則不允許熄滅泄漏處的火焰。噴水冷卻容器,可能的話將容器從火場移至空曠處。滅火劑:泡沫、二氧化碳、乾粉。
應急處理:迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿防靜電工作服。儘可能切斷泄漏源。合理通風,加速擴散。噴霧狀水稀釋。如有可能,將漏出氣用排風機送至空曠地方或裝設適當噴頭燒掉。漏氣容器要妥善處理,修復、檢驗后再用。
該物質對環境有危害,對魚類應給予特別注意。還應特別注意對地表水、土壤、大氣和飲用水的污染。
檢測
現場監測:攜帶型氣相色譜法;氣體檢測管法;氣體速測管
實驗室:氣相色譜法《空氣中有害物質的測定方法》(第二版),杭士平編 5環境標準。
注意事項
操作注意事項:密閉操作,全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員穿防靜電工作服。遠離火種、熱源,工作場所嚴禁吸煙。使用防爆型的通風系統和設備。防止氣體泄漏到工作場所空氣中。避免與氧化劑、鹵素接觸。在傳送過程中,鋼瓶和容器必須接地和跨接,防止產生靜電。搬運時輕裝輕卸,防止鋼瓶及附件破損。配備相應品種和數量的消防器材及泄漏應急處理設備。
儲存注意事項:儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與氧化劑、鹵素分開存放,切忌混儲。採用防爆型照明、通風設施。禁止使用易產生火花的機械設備和工具。儲區應備有泄漏應急處理設備。
