碳酸鹽
金屬元素陽離子和碳酸根相化合而成的鹽類
碳酸鹽可分正鹽 M2CO3、酸式鹽 MHCO3及鹼式碳酸鹽M2(OH)2CO3(M為金屬)三類。自然界存在的碳酸鹽礦有方解石、文石(霰石)、菱鎂礦、白雲石、菱鐵礦、菱錳礦、菱鋅礦、白鉛礦、碳酸鍶礦和毒重石等。碳酸鹽和酸式碳酸鹽(又稱重碳酸鹽)大多數為無色的。鹼金屬和銨的碳酸鹽易溶於水,其他金屬的碳酸鹽都難溶於水。碳酸氫鈉在水中的溶解度較小,其他酸式碳酸鹽都易溶於水。含有氫氧基團的金屬離子碳酸鹽稱為鹼式鹽,為復鹽。重要的有鹼式碳酸銅[CuCO3·Cu(OH)2]、鹼式碳酸鉛[2PbCO3·Pb(OH)2]等及自然界存在的藍銅礦[Cu3(CO3)2(OH)2]、孔雀石[Cu2(OH)2CO3]等。

碳酸鹽含量自動測定儀
要是、,其次、以及、、、、等。一些碳酸鹽礦物具有完好的單晶體,也可呈塊狀、粒狀、放射狀和土狀等集合體形態。碳酸鹽礦物大多數為無色或白色,含銅者呈鮮綠或鮮藍色,含錳者呈玫瑰紅色,含稀土者或鐵者呈褐色,含鈷者呈淡紅色,含鈾者呈黃色。礦物硬度不大,一般在3左右。最大的是稀土碳酸鹽礦物的硬度,但也不超過4.5,非金屬光澤為主。碳酸鹽礦物主要為外生成因,分佈廣泛,可形成大面積分佈的海相沉積地層。內生成因的碳酸鹽岩多數出現在岩漿熱液階段。
A salt of carbonic acid in which one hydrogen atom has been replaced; an acid carbonate.
含有兩個碳酸根的鹽類.
:
用標準 鹽酸溶液滴定水樣時,若以酚酞作指示劑,滴定到等當點時,pH為8.4,此時消耗的酸量僅相當於碳酸鹽含量的一半,當再向溶液中加入甲基橙指示劑,繼續滴定到等當點時,溶液的ph值為4. 4,這時所滴定的是由碳酸鹽所轉變的重碳酸鹽和水樣 中原有的重碳酸鹽的總和,根據酚酞和甲基橙指示的兩次終點時所消耗的鹽酸 標準溶液的體積,即可分別計算碳酸鹽和重 碳酸鹽的含量。
化學式:
外觀:白色粉末、無毒、無味。
用途:可用於生產人造絲、化肥行業的脫硫劑、催化劑的主要原料,在橡膠製品、油漆其它化工產品中也可廣泛應用,在石油鑽井中,本品能與HS反應生成穩定的不溶性ZnS,且該品加入泥漿后不影響泥漿性能,因而可有效的消除HS的污染和腐蝕,用作含HS油氣井的 緩蝕劑,除硫劑。
碳酸鹽和酸式碳酸鹽大多數為無色的。
關於碳酸鹽在水中的溶解性,一般來說,碳酸鹽難溶的金屬,碳酸氫鹽溶解度相對較大;而碳酸鹽易溶的金屬,碳酸氫鹽的溶解度則明顯減小。普遍認為是離子在溶液中形成了氫鍵相互締合,使溶解度減小的緣故。可溶性碳酸鹽在水溶液中都會水解,使溶液呈鹼性。如0.1Μ碳酸鈉溶液的pH為11.6,其溶液中存在分步水解平衡:
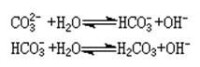
碳酸鹽水解

碳酸鹽在酸中的反應
碳酸鹽在加熱時都會分解成金屬氧化物並放出二氧化碳,此反應為非氧化還原反應。(對於碳酸銀,加熱後由於Ag2O不穩定,即分解為單質銀和氧氣。)不同碳酸鹽的熱穩定性差異很大。其中鹼金屬和鹼土金屬碳酸鹽的熱穩定性較高,必須灼燒至高溫才分解;而有些金屬的碳酸鹽的熱穩性較低,加熱到100℃左右就分解,如碳酸鈹等;有的碳酸鹽在常溫下就可以分解,如碳酸汞。酸式碳酸鹽的熱穩定性比相同金屬的碳酸鹽低得多。例如碳酸鈉,要851℃以上才開始分解,而碳酸氫鈉在270℃左右就明顯分解:
碳酸鹽分解
碳酸鹽的製備方法有以下四種:
①氨鹼法:
碳酸鹽氨鹼法的製作
酸式碳酸鹽熱分解沉澱法
2NaOH+→+
++─→
③ 可溶性碳酸鹽沉澱難溶碳酸鹽法:
+─→+2NaCl
④ 酸式碳酸鹽熱分解沉澱法:
酸式碳酸鹽通常可用碳酸鹽進一步吸收二氧化碳的反應製備:
++─→
也可用鹼吸收過量二氧化碳製備:
KOH+─→
++─→
此外,難溶的鹼式碳酸鹽可由某些金屬的可溶性鹽類溶液中加入鹼金屬碳酸鹽溶液來製備:
式中M為Be、Mg、Cu等。
應用 在碳酸鹽中,純鹼(碳酸鈉)是重要的化工原料,廣泛應用於化工、玻璃、肥皂、造紙、紡織和食品等工業。鉀鹼(碳酸鉀)是玻璃生產的主要原料。小蘇打(碳酸氫鈉)廣泛用於醫藥和食品工業,也常用於製造滅火器。石灰石、大理石、白雲石可用於建築、水泥和鋼鐵等工業。
