碳酸氫鹽
碳酸氫鹽
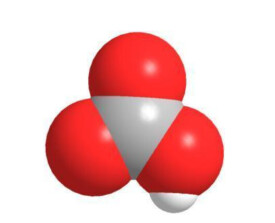
碳酸氫根離子的結構。碳酸氫根為平面結構,碳位於中心,與三個氧原子相連。它是碳酸的共軛鹼,也是碳酸根離子的共軛酸。水溶液中存在下列平衡,碳酸氫根既可發生電離生成水合氫離子,也會水解出氫氧根離子,水解程度大於電離,因此水溶液呈弱鹼性。
碳酸氫鹽分為標準碳酸氫鹽和實際碳酸氫鹽,標準碳酸氫鹽( standard bicarbonate,SB)是指全血標本在標準條件下(即在38℃和血紅蛋白完全氧合的條件下),用 PaCO2,為40mmHg 的氣體平衡后所測得的血漿HCO3濃度。由於標準化後排除了呼吸因素的影響,故SB是僅反映代謝因素的指標,正常值為22 ~27mmol/L,平均為24mmol/L。SB在代謝性酸中毒時下降,代謝性鹼中毒時升高;在慢性呼吸性酸中毒或鹼中毒時,經腎臟代償后也可繼發性增高或降低。
實際碳酸氫鹽( actual bicarbonate,AB)是指隔絕空氣的全血標本,在實際PaCO2,和實際血氧飽和度的條件下測得的血漿HCO3濃度。AB受呼吸和代謝兩個因素影響,正常情況下AB= SB,AB和SB均降低表明有代謝性酸中毒,AB和SB均升高表明有代謝性鹼中毒。AB和SB的差值反映呼吸性因素對酸鹼平衡紊亂的影響,AB > SB表明有CO蓄積,見於呼吸性酸中毒或代償后的代謝性鹼中毒;AB呼吸性鹼中毒或代償后的代謝性酸中毒。
碳酸氫鈉
碳酸氫鉀
碳酸氫鈣
碳酸氫銨
碳酸氫鹽的主要性質是它的溶解性、水解性和熱穩定性。
鹼金屬和銨的碳酸鹽易溶於水,其他金屬的碳酸鹽難溶於水。碳酸氫鹽的溶解性有兩種情況:①難溶性碳酸鹽對應的碳酸氫鹽都有較大的溶解度,如 碳酸鈣與 碳酸氫鈣;②易溶的碳酸鹽對應的碳酸氫鹽都有相對較低的溶解度,如碳酸鈉與碳酸氫鈉。
自然界中不斷進行著碳酸鈣與碳酸氫鈣的轉化。空氣中的二氧化碳溶於水后和碳酸鈣發生作用,生成碳酸氫鈣進入天然水中;而天然水中的碳酸氫鈣經自然分解或人工加熱又析出碳酸鈣。這是碳酸鹽在自然界中分佈廣泛的重要原因,也是鐘乳石、石筍的形成和暫時硬水軟化的基本原理。
碳酸鹽和碳酸氫鹽在水溶液中水解都顯鹼性。由於碳酸鹽的水解作用產生碳酸根,碳酸氫根,氫氧根離子,當其他金屬離子(鹼金屬離子和銨離子除外)遇到可溶性碳酸鹽溶液時,會生成3 種不同的沉澱:碳酸鹽、鹼式碳酸鹽或氫氧化物。究竟生成哪一種沉澱取決於反應物、生成物的性質和反應條件。一 般地,氫氧化物鹼性較強的金屬離子可沉澱為碳酸鹽;氫氧化物鹼性較弱的金屬離子可沉澱為鹼式碳酸鹽;強水解性的金屬離子(特別是兩性的)可沉澱為氫氧化物。
碳酸鹽的熱穩定性有一定的規律性。根據組成碳酸鹽的陽離子的不同,碳酸鹽的熱穩定性順序一般可表示為鹼金屬碳酸鹽 > 鹼土金屬碳酸鹽 > 過渡金屬碳酸鹽
碳酸鹽熱分解的難易程度主要與陽離子的極化作用有關。由於陽離子對碳酸根離子產生極化作用,而使碳酸根離子不穩定以致分解。這種極化作用越大,碳酸鹽越不穩定。質子的極化作用超過一般的金屬離子,因此,根據組成碳酸鹽的陰離子的不同,又有下列熱穩定順序:
M2CO3>M(HCO3)2>H2CO3
碳酸氫鹽