離子化合物
離子化合物
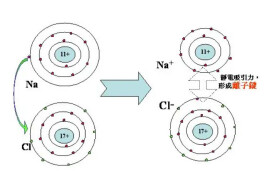
離子化合物是由陽離子和陰離子構成的化合物。活潑金屬(如鈉、鉀、鈣、鎂等)與活潑非金屬(如氟、氯、氧、硫等)相互化合時,活潑金屬失去電子形成帶正電荷的陽離子(如Na、K、Ca、Mg等),活潑非金屬得到電子形成帶負電荷的陰離子(如F、Cl、O、S等),陽離子和陰離子靠靜電作用形成了離子化合物。例如,氯化鈉即是由帶正電的鈉離子(Na)和帶負電的氯離子(Cl)構成的離子化合物。在離子化合物里陽離子所帶的正電荷總數等於陰離子所帶的負電荷總數,整個化合物呈電中性。
離子化合物,是由陰離子(Anion,帶負電)和陽離子(Cation,帶正電)組成,以本質上是庫侖力的離子鍵相結合的化合物。離子化合物通常熔點和沸點較高,熔融時或電離產生其組成離子的水溶液中時能導電。大部分離子化合物在常溫下是固體,但也有一些常溫下存在於液態離子化合物,它們通常是一些含有複雜有機組份的鹽。注意液態離子化合物和離子化合物溶液的區別,後者中含有一些不具電性的分子。
離子化合物是由陽離子和陰離子構成的化合物。活潑金屬(如鈉、鉀、鈣、鎂等)與活潑非金屬(如氟、氯、氧、硫等)相互化合時,活潑金屬失去電子形成帶正電荷的陽離子(如等),活潑非金屬得到電子形成帶負電荷的陰離子(如等),陽離子和陰離子靠靜電作用形成了離子化合物。例如,氯化鈉即是由帶正電的鈉離子()和帶負電的氯離子()構成的離子化合物。在離子化合物里陽離子所帶的正電荷總數等於陰離子所帶的負電荷總數,整個化合物呈電中性。
由陰、陽離子相互作用而構成的化合物,這就叫做離子化合物(ionic compound)
代表物:
鹼性氧化物()
鹽(NaCl)
鹼[NaOH]
離子化合物(ionic compound)是存在於:
1、活潑金屬(指第一和第二主族的金屬元素)與活潑的非金屬元素(指第六和第七主族的元素)之間形成的化合物
2、金屬元素與酸根離子之間形成的化合物。(酸根離子如硫酸根離子SO₄²-、硝酸根離子、碳酸根離子等等);
3、銨根離子()和酸根離子之間,或銨根離子與非金屬元素之間,例如、。
4、NaH,KH等活潑金屬氫化物。
離子化合物都是電解質。在熔融狀態下:都可以導電(此類物質加熱時易分解或易氧化)。在水中:有的可以導電,有的不可以導電(此類物質易與水反應或不溶於水)。在原電池中的作用:形成閉合電路。
離子化合物和共價化合物都涉及到電子的移動。
離子化合物是通過離子鍵形成的化合物,離子鍵是由電子轉移(失去電子者為陽離子,獲得電子者為陰離子)形成的。即正離子和負離子之間由於靜電作用所形成的化學鍵。
而共價化合物是通過共用電子構成的共價鍵結合而成的化合物,共價鍵是化學鍵的一種,兩個或多個原子共同使用它們的外層電子,在理想情況下達到電子飽和的狀態,由此組成比較穩定和堅固的化學結構叫做共價鍵。與離子鍵不同的是進入共價鍵的原子向外不顯示電性,因為它們並沒有獲得或損失電子。共價鍵的強度比氫鍵要強,與離子鍵差不太多或甚至比離子鍵強。
常見的離子化合物:鹼,NaCl,CsCl,NaO,NHCl等大多數的鹽!並不是所有的鹼、鹽
| 離子化合物 | 共價化合物 | |
| 構成粒子 | 陰、陽離子 | 分子或原子(SiC) |
| 離子間的作用 | 離子鍵 | 分子或原子之間存在的共價鍵 |
| 熔沸點 | 較高 | 一般較低,少部分很高(如SiO) |
| 導電性 | 熔融態或水溶液導電 | 熔融態不導電,溶於水有的導電(硫酸),有的不導電(蔗糖) |
| 熔化時破壞的作用力 | 一定破壞離子鍵,可能破壞共價鍵(如碳酸氫鈉) | 一般不破壞共價鍵,極少部分破壞共價鍵(SiO) |
| 實例 | 強鹼、多數鹽、活潑金屬的氧化物或過氧化物或超氧化物 | 酸、非金屬的氫化物、氧化物 |
(1)根據化合物組成元素的性質來判斷
(2)根據構成化合物的離子鍵是以離子鍵還是以共價鍵結合來判斷
(3)根據化合物的類型來判斷
(4)根據化合物的導電性來判斷
(5)根據化合物的熔沸點來判斷
離子化合物 由陽離子和陰離子組成的化合物。活潑金屬(如鉀、鈣、鈉、鎂等)與活潑非金屬(如氟、氯、氧、硫等)相互化合時,活潑金屬失去電子形成帶正電荷的陽離子(如等),活潑非金屬得到電子形成帶負電荷的陰離子(如等)。
陽離子和陰離子靠靜電作用形成了離子化合物。例如,氯化鈉即是由帶正電的鈉離子()和帶負電的氯離子()構成的離子化合物。許多鹼(如等)和鹽(如等)都是離子化合物。
在離子化合物里陽離子所帶的正電荷總數等於陰離子所帶的負電荷總數,整個化合物呈電中性。多數離子化合物在固態(或晶態)時不能導電,而它的水溶液或熔化狀態則能導電。離子化合物一般說來,熔點和沸點較高,硬度較大,質脆,難於壓縮,難揮發。
某些鹼性氧化物,如、,常見的鹽類如NaCl、KF,常見的鹼,如NaOH等都屬於離子化合物。
離子化合物是存在於:
1、活潑金屬(指第一和第二主族的金屬元素)與活潑的非金屬元素(指第六和第七主族的元素)之間形成的化合物。
2、金屬元素與酸根離子之間形成的化合物(酸根離子如硫酸根離子、硝酸根離子、碳酸根離子等等)。
3、銨根離子()和酸根離子之間,或銨根離子與非金屬元素之間。
共價化合物存在於非金屬元素之間,對於由兩種元素形成的化合物。如果存在於同種非金屬元素之間那麼是非極性共價鍵,如是不同種元素之間形成的是極性共價鍵,他們都是共價化合物。
離子化合物都是電解質,且在水溶液或熔融狀態下可以導電。在原電池中的作用:形成閉合電路!
離子化合物中一定含有至少一個離子鍵,並且可能同時含有共價鍵。
離子化合物和共價化合物都涉及到電子的移動。
離子化合物是通過離子鍵形成的化合物,離子鍵是由電子轉移(失去電子者為陽離子,獲得電子者為陰離子)形成的。即正離子和負離子之間由於靜電作用所形成的化學鍵。
而共價化合物是通過共用電子構成的共價鍵結合而成的化合物,共價鍵是化學鍵的一種,兩個或多個原子共同使用它們的外層電子,在理想情況下達到電子飽和的狀態,由此組成比較穩定和堅固的化學結構叫做共價鍵。與離子鍵不同的是進入共價鍵的原子向外不顯示電性,因為它們並沒有獲得或損失電子。共價鍵的強度比氫鍵要強,與離子鍵差不太多或甚至比離子鍵強。
根據化合物組成元素的性質來判斷
根據構成化合物的離子鍵是以離子鍵還是以共價鍵結合來判斷
根據化合物的類型來判斷
根據化合物的導電性來判斷
根據化合物的熔沸點來判斷
具體來說,強鹼、鹽(包括銨鹽)和大部分金屬氧化物都是離子化合物,但不僅僅這些,詳見離子化合物的存在形式。
離子聚合物又稱離聚物,是指碳氫分子鏈中含有少量離子基團的聚合物,通常認為離子基團的摩爾含量不超過15%。它的主要部分是一個非離子性的主鏈,次要部分是一種可離子化的或離子性的共聚單體。