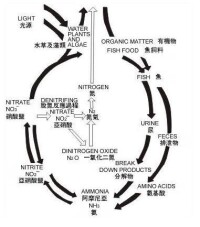
硝酸鹽
硝酸HNO3與金屬反應形成的鹽類
硝酸鹽,是硝酸HNO3與金屬反應形成的鹽類。由金屬離子(或銨離子)和硝酸根離子組成。常見的硝酸鹽有硝酸鈉、硝酸鉀、硝酸銨、硝酸鈣、硝酸鉛、硝酸鈰等。
2017年10月27日,世界衛生組織國際癌症研究機構公布的致癌物清單初步整理參考,在導致內源性亞硝化條件下攝入的硝酸鹽或亞硝酸鹽在2A類致癌物清單中
由金屬離子或銨根離子與硝酸根離子組成的鹽類。
nitrate硝酸HNO3的鹽類。由金屬離子和硝酸根離子組成的化合物,重要的有:硝酸鈉、硝酸鉀、硝酸銨、硝酸鈣、硝酸鉛、硝酸鈰等。如:AgNO3(銀離子和硝酸根離子),Zn(NO3)2(鋅離子和硝酸根離子)……都是硝酸鹽。NaNO3(鈉離子和硝酸根離子)只是“硝酸鹽”的一種。硝酸鹽幾乎全部易溶於水,只有硝酸脲微溶於水,鹼式硝酸鉍難溶於水,所以溶液中硝酸根不能被其他絕大多數陽離子沉澱。硝酸鹽大量存在於自然界中,主要來源是固氮菌固氮形成,或在閃電的高溫下空氣中的氮氣與氧氣直接化合成氮氧化物,溶於雨水形成硝酸,在與地面的礦物反應生成硝酸鹽。固體的硝酸鹽加熱時能分解放出氧,其中最活潑的金屬的硝酸鹽僅放出一部分氧而變成亞硝酸鹽,其餘大部分金屬的硝酸鹽,分解為金屬的氧化物、氧和二氧化氮。硝酸鹽在高溫或酸性水溶液中是強氧化劑,但在鹼性或中性的水溶液幾乎沒有氧化作用。主要用途是供植物吸收的氮肥,氮元素不僅是氨基酸與蛋白質的主要成分,還可以合成葉綠素,促進光合作用,所以如果植物缺氮就會葉子枯黃。硝酸鈉和硝酸鈣是很好的氮肥。硝酸鉀是制黑色火藥的原料。硝酸銨可作肥料,也可制炸藥。由硝酸作用於相應的金屬或金屬氧化物等而製得。
無公害蔬菜硝酸鹽的含量應控制在一定範圍內。因此在栽培上施肥應圍繞著降低硝酸鹽含量而進行,故巧施肥是無公害蔬菜生產的關鍵,在施肥過程中應掌握以下的技巧。一是重施有機肥有機肥不會導致蔬菜硝酸鹽污染,耐貯存,品質好。但用於蔬菜的有機肥應充分腐熟。沼液是無害化優質肥料,經常施用病蟲少,可減少農藥用量,提高蔬菜產量,能生產出最佳的無公害蔬菜。二是不施硝態氮蔬菜施用硝酸銨、硝酸鈣和硝酸鉀等硝酸肥,容易使蔬菜積累硝酸鹽。而施用碳銨、硫酸銨、和尿素等肥料,應控制用量,並深施蓋土,可減少蔬菜對硝酸鹽的積累。三是因季節施肥夏秋季氣溫高,不利於積累硝酸鹽,可適量地施氮肥。冬春季氣溫低,光照弱,硝酸鹽還原酶活性下降,容易累硝酸鹽,應不施或少施氮肥。四是因地施肥肥力高,富含有機腐植質的土壤,蔬菜易積累硝酸鹽,宜禁施氮肥。低肥菜地,蔬菜積累的硝酸鹽較輕,可施氮肥和有機肥以培肥地力。五是早施苗肥苗期施氮肥較好,有利於蔬菜早發、快長,降低硝酸鹽含量。六是控制氮肥用量蔬菜中硝酸鹽的積累隨著施肥量的增加而提高。因此,每667平方米施氮量應控制在純氮15公斤內,2/3作基肥,1/3作苗肥深施。七是葉菜不施尿素葉面肥葉面施氮肥使其直接與空氣接觸,銨離子易變成 硝酸根離子被葉子吸收,硝酸鹽積累增加,因此葉菜不宜施尿素葉面肥。八是控制廢水、污水淋灌廢水、污水含大量重金屬離子、毒物、病菌和蟲卵等,直接污染蔬菜無公害蔬菜的施肥。
1.硝酸鉀
別名:土硝:硝石、火硝;分子式:KNO3;分子量:101.11。
性狀:白色透明斜方晶系或菱形繫結晶體或者白色粉末。無嗅無毒,味咸辣有清涼感。空氣中不潮解,易溶於水、液氨、甘油,不溶於無水乙醇與乙醚。硝酸鉀是強氧化劑,與易燃物、有機物等接觸能引起燃燒爆炸,併發生有毒和刺激性氣體,與炭或硫一起加熱時,能發強光而燃燒。
製作方法:硝酸鉀可採用轉化法、硝石法和吸收法製作生產。
應用範圍:醫藥工業用於生產青霉素鉀鹽等藥劑;機械工業用於熱處理時淬火之鹽浴;化學工業用於製造黑色炸藥;農業上用作農作物的氮鉀肥料。此外,在火柴、陶瓷、玻璃、礦業等生產活動中,也都需要硝酸鉀。
包裝及儲運:一般用50千克內襯塑料袋,外套編織袋包裝。屬於一級無機氧化劑,危規編號為21027。應儲存於乾燥的庫房中,不可與有機物、還原劑及易燃物(硫、磷、木炭等)共儲混運。搬運時應輕拿輕放,防止包裝破損。
2.硝酸銀
分子式:AgN03;分子量:169.87。
製作方法:由金屬銀與硝酸直接反應製得。
應用範圍:用於製造照相底片和電影膠片的感光材料;用於保溫瓶膽及鏡子鍍銀、電子元件的鍍銀以增加導電性能;醫藥上用作殺菌劑、腐蝕劑、日化工業用於染毛髮等。
包裝儲運:使用l千克深棕色大口玻璃瓶裝,外套木箱包裝。應儲存於通風陰涼乾燥的庫房內,以免露光和潮解。不可與有機物共儲混運。失火時可用水或二氧化碳滅火機撲救。
硝酸鹽
在液態 N2O4 中反應:
Ni(CO)4 + N2O4 → Ni(NO3)2 + 2NO + 4CO
在純 HNO3-N2O5 或液態 N2O5 中反應:
TiCl4 + 4N2O5 → Ti(NO3)4 + 2N2O4 + 2Cl2
與鹵素的硝酸鹽在低溫反應。如硝酸氯 ClNO3:
TiCl4 + 4ClNO3 −(-80℃)→ Ti(NO3)4 + 2Cl2
某些金屬還可形成通式為 MOx(NO3)y 的鹼式硝酸鹽,如 BiO(NO3)2。
大多數硝酸鹽為離子型晶體,易溶於水。某些無水鹽具有揮發性。
結構硝酸根離子具有以下共振式:硝酸根離子,其中氮氧鍵介於單雙鍵之間。分解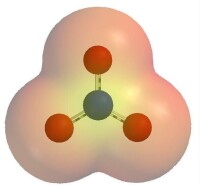 硝酸鹽分解的產物可以是:亞硝酸鹽和氧氣(鹼金屬和鹼土金屬的硝酸鹽);金屬氧化物和氮氧化物(鎂和銅之間的硝酸鹽);金屬單質(銅后金屬硝酸鹽)。
硝酸鹽分解的產物可以是:亞硝酸鹽和氧氣(鹼金屬和鹼土金屬的硝酸鹽);金屬氧化物和氮氧化物(鎂和銅之間的硝酸鹽);金屬單質(銅后金屬硝酸鹽)。

硝酸根離子的靜電勢能圖,可以看出氧原子聚集了大部分的負電荷。
配位化合物硝酸根和金屬離子可以按多種方式配位,包括單齒、雙齒、叄齒或端梢、橋式等。檢驗 硝酸根離子可在酸性介質中,通過和鐵(II)反應產生棕色環加以定性檢出。參見棕色環實驗。總反應為:3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O雖然該反應已有很久的歷史,但其機理卻是不久前經分光光度法及電位滴定法的系統研究后才弄清楚的:Fe2+ + NO3- + 2H+ → Fe3+ + NO2 + H2OFe2+ + NO2 + H+ → Fe3+ + HNO2Fe2+ + HNO2 + H+ → Fe3+ + NO + H2OFe2+ + NO → FeNO2+2NO2 + H2O → HNO2 + NO3- + H+2HNO2 → NO + NO2 + H2ONO + NO3- + H+ → NO2 + HNO2其中棕色環是由 FeNO2+(第四步)引起的,速控步則是最後一步。危害硝酸鹽(NO3—)與亞硝酸鹽(NO2—)分別是硝酸(HNO3)和亞硝酸(HNO2)的酸根,它們作為環境污染物而廣泛地存在於自然界中,尤其是在氣態水、地表水和地下水中以及動植物體與食品內。環境中硝酸鹽與亞硝酸鹽的污染來源很多,如:1.人工化肥:有硝酸銨、硝酸鈣、硝酸鉀、硝酸鈉和尿素等;2.生活污水、生活垃圾與人畜糞便,據測試1升生活污水在自然降解過程中,可產生110毫克硝酸鹽;1公斤垃圾糞便堆肥在自然條件下經淋濾分解后,可產生492毫克硝酸鹽;3.食品、燃料、煉油等工廠排出大量的含氨廢棄物,經過生物、化學轉換后均形成硝酸鹽進入環境中;4.汽車、火車、輪船、飛機、鍋爐、民用爐等燃燒石油類燃料、煤炭、天然氣,可產生大量氮氧化物,平均燃燒1噸煤、1千升油和1萬立方米天然氣可分別產生二氧化氮氣體9、13與63公斤,這些二氧化氮氣體經降水淋溶后可形成硝酸鹽降落到地面和水體中;5.食品防腐與保鮮:硝酸鹽與亞硝酸鹽被廣泛用在肉品和魚的防腐和保存上,以使肉製品呈現紅色和香味,在每公斤肉食品中加入亞硝酸鹽(一般為亞硝酸鈉)5毫克以下,在一定時間內肉色觀感良好;加入20毫克以上,可呈現商業上需要的穩定色彩;加入50毫克則有特殊氣味。環境中化肥施用、污水灌溉、垃圾糞便、工業含氮廢棄物、燃料燃燒排放的含氮廢氣等在自然條件下,經降水淋溶分解后形成硝酸鹽,流入河、湖並滲入地下,從而造成地表水和地下水的硝酸鹽污染。如污水下滲、污灌和濫施化肥可使地下水硝酸鹽含量由數毫克/升劇增至400毫克/升以上(國家生活飲用水硝酸鹽含量衛生標準小於88.6毫克/升,以氮計小於20毫克/升);濫施化肥、污灌、用硝酸鹽污染的水源灌溉也使農作物吸收了大量的硝酸鹽類,如過分施肥所產的菠菜中每公斤乾重可含亞硝酸鹽達3600毫克。還有腌制的漬酸菜、經過長途運輸和長期貯存的蔬菜以及隔夜的熟蔬菜不僅硝酸鹽含量大量增加,而且在硝酸鹽還原菌的作用下,硝酸鹽被還原為亞硝酸鹽。上述含有大量硝酸鹽與亞硝酸鹽的飲水、蔬菜、糧食、魚、肉製品、漬酸菜、隔夜炒菜等經人食用后,大量亞硝酸鹽可使人直接中毒,而且硝酸鹽在人體內也可被還原為亞硝酸鹽。亞硝酸鹽與人體血液作用,形成高鐵血紅蛋白,從而使血液失去攜氧功能,使人缺氧中毒,輕者頭昏、心悸、嘔吐、口唇青紫,重者神志不清、抽搐、呼吸急促,搶救不及時可危及生命。不僅如此,亞硝酸鹽在人體內外與仲胺類作用形成亞硝胺類,它在人體內達到一定劑量時是致癌、致畸、致突變的物質,可嚴重危害人體健康。為了防止硝酸鹽與亞硝酸鹽的危害,除了要科學合理地施用化肥、禁止使用污水灌溉、實行污水、垃圾與糞便無害化處理等環保措施以保護地表水與地下水源不遭受硝酸鹽和亞硝酸鹽污染外,還應盡量少吃腌制、熏制、臘制的魚、肉類、香腸、臘肉、火腿、罐頭食品、漬酸菜、鹽腌不久的菜;不買存放過久、隔日或發蔫的蔬菜;當日買的菜當日吃完;不吃隔夜的熟蔬菜;不可將剩飯菜長久存放;不可將工業用亞硝酸鹽(如亞硝酸鈉)當做食鹽誤食。去除器水族箱水質中所包含的硝酸鹽(NO3)應該不具毒性的的,但是硝酸鹽是水族箱的“隱形殺手”。硝酸鹽去除器是利用水質處理細菌去除水族箱水質中硝酸鹽的一種過濾設備,可以充分利用水質處理細菌的作用將水質中硝酸鹽還原,將硝酸鹽含量降低於50mg/L,甚至更低的無害等級。工作原理是利用一種水質處理細菌將硝酸鹽作為它代謝中的需氧物質,NO3最終代謝成為N2和CO2。氧被運用於代謝過程中。則被排入N2 大氣中,代謝的生成物為CO2。在硝酸鹽去除器內部填充著大量生物過濾球,為了避免底部積水造成滯留區,由動力馬達將水不斷從容器底部抽到頂端,然後又噴淋於生物過濾球的表面,如此再流回底部始終保持生物過濾球的濕潤狀態。生物過濾球表面附著生長的水質處理細菌會不斷吸收容器內部的氧氣分裂繁殖,一旦容器中的氧氣耗盡,它們就吸收NO3離子中的,並NO3將還原成為NO2,並在最終再將NO2中的氧全部吸收,還原為N2排入大氣中。整個過程中,水流的氧化還原電流自正極轉向負極不斷地下降,可以通過氧化還原電位確定硝酸鹽去除的程度。基於硝酸鹽去除器中的水是在沒有溶氧的情況下被還原成為氮,還原反應是主導的,因此氧化還原的電流很低,通常在-50mv-250mv。氧化還原的電流高於- 50mv的時候,硝酸鹽去除的反應停留在硝酸鹽階段,如果氧化還原的電流低於-300mv的時候,硝酸鹽則已經全部被還原,於是這些水質處理細菌就會汲取硝酸鹽的氧產生HS。所以當氧化還原電位指示其電流不到-50mv或呈正極的時候,就要控制水族箱中的水繼續流入硝酸鹽去除器中。當氧化還原電位指示其電流低於-300mv的時候,就需要增加水族箱的水進入硝酸鹽去除器。只有密切注意硝酸鹽去除器的氧化還原電位的變化才能夠保證硝酸鹽去除的正常進行。
硝酸根離子可在酸性介質中,通過和鐵(II)反應產生棕色環加以定性檢出。參見棕色環實驗。總反應為:3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O雖然該反應已有很久的歷史,但其機理卻是不久前經分光光度法及電位滴定法的系統研究后才弄清楚的:Fe2+ + NO3- + 2H+ → Fe3+ + NO2 + H2OFe2+ + NO2 + H+ → Fe3+ + HNO2Fe2+ + HNO2 + H+ → Fe3+ + NO + H2OFe2+ + NO → FeNO2+2NO2 + H2O → HNO2 + NO3- + H+2HNO2 → NO + NO2 + H2ONO + NO3- + H+ → NO2 + HNO2其中棕色環是由 FeNO2+(第四步)引起的,速控步則是最後一步。危害硝酸鹽(NO3—)與亞硝酸鹽(NO2—)分別是硝酸(HNO3)和亞硝酸(HNO2)的酸根,它們作為環境污染物而廣泛地存在於自然界中,尤其是在氣態水、地表水和地下水中以及動植物體與食品內。環境中硝酸鹽與亞硝酸鹽的污染來源很多,如:1.人工化肥:有硝酸銨、硝酸鈣、硝酸鉀、硝酸鈉和尿素等;2.生活污水、生活垃圾與人畜糞便,據測試1升生活污水在自然降解過程中,可產生110毫克硝酸鹽;1公斤垃圾糞便堆肥在自然條件下經淋濾分解后,可產生492毫克硝酸鹽;3.食品、燃料、煉油等工廠排出大量的含氨廢棄物,經過生物、化學轉換后均形成硝酸鹽進入環境中;4.汽車、火車、輪船、飛機、鍋爐、民用爐等燃燒石油類燃料、煤炭、天然氣,可產生大量氮氧化物,平均燃燒1噸煤、1千升油和1萬立方米天然氣可分別產生二氧化氮氣體9、13與63公斤,這些二氧化氮氣體經降水淋溶后可形成硝酸鹽降落到地面和水體中;5.食品防腐與保鮮:硝酸鹽與亞硝酸鹽被廣泛用在肉品和魚的防腐和保存上,以使肉製品呈現紅色和香味,在每公斤肉食品中加入亞硝酸鹽(一般為亞硝酸鈉)5毫克以下,在一定時間內肉色觀感良好;加入20毫克以上,可呈現商業上需要的穩定色彩;加入50毫克則有特殊氣味。環境中化肥施用、污水灌溉、垃圾糞便、工業含氮廢棄物、燃料燃燒排放的含氮廢氣等在自然條件下,經降水淋溶分解后形成硝酸鹽,流入河、湖並滲入地下,從而造成地表水和地下水的硝酸鹽污染。如污水下滲、污灌和濫施化肥可使地下水硝酸鹽含量由數毫克/升劇增至400毫克/升以上(國家生活飲用水硝酸鹽含量衛生標準小於88.6毫克/升,以氮計小於20毫克/升);濫施化肥、污灌、用硝酸鹽污染的水源灌溉也使農作物吸收了大量的硝酸鹽類,如過分施肥所產的菠菜中每公斤乾重可含亞硝酸鹽達3600毫克。還有腌制的漬酸菜、經過長途運輸和長期貯存的蔬菜以及隔夜的熟蔬菜不僅硝酸鹽含量大量增加,而且在硝酸鹽還原菌的作用下,硝酸鹽被還原為亞硝酸鹽。上述含有大量硝酸鹽與亞硝酸鹽的飲水、蔬菜、糧食、魚、肉製品、漬酸菜、隔夜炒菜等經人食用后,大量亞硝酸鹽可使人直接中毒,而且硝酸鹽在人體內也可被還原為亞硝酸鹽。亞硝酸鹽與人體血液作用,形成高鐵血紅蛋白,從而使血液失去攜氧功能,使人缺氧中毒,輕者頭昏、心悸、嘔吐、口唇青紫,重者神志不清、抽搐、呼吸急促,搶救不及時可危及生命。不僅如此,亞硝酸鹽在人體內外與仲胺類作用形成亞硝胺類,它在人體內達到一定劑量時是致癌、致畸、致突變的物質,可嚴重危害人體健康。為了防止硝酸鹽與亞硝酸鹽的危害,除了要科學合理地施用化肥、禁止使用污水灌溉、實行污水、垃圾與糞便無害化處理等環保措施以保護地表水與地下水源不遭受硝酸鹽和亞硝酸鹽污染外,還應盡量少吃腌制、熏制、臘制的魚、肉類、香腸、臘肉、火腿、罐頭食品、漬酸菜、鹽腌不久的菜;不買存放過久、隔日或發蔫的蔬菜;當日買的菜當日吃完;不吃隔夜的熟蔬菜;不可將剩飯菜長久存放;不可將工業用亞硝酸鹽(如亞硝酸鈉)當做食鹽誤食。去除器水族箱水質中所包含的硝酸鹽(NO3)應該不具毒性的的,但是硝酸鹽是水族箱的“隱形殺手”。硝酸鹽去除器是利用水質處理細菌去除水族箱水質中硝酸鹽的一種過濾設備,可以充分利用水質處理細菌的作用將水質中硝酸鹽還原,將硝酸鹽含量降低於50mg/L,甚至更低的無害等級。工作原理是利用一種水質處理細菌將硝酸鹽作為它代謝中的需氧物質,NO3最終代謝成為N2和CO2。氧被運用於代謝過程中。則被排入N2 大氣中,代謝的生成物為CO2。在硝酸鹽去除器內部填充著大量生物過濾球,為了避免底部積水造成滯留區,由動力馬達將水不斷從容器底部抽到頂端,然後又噴淋於生物過濾球的表面,如此再流回底部始終保持生物過濾球的濕潤狀態。生物過濾球表面附著生長的水質處理細菌會不斷吸收容器內部的氧氣分裂繁殖,一旦容器中的氧氣耗盡,它們就吸收NO3離子中的,並NO3將還原成為NO2,並在最終再將NO2中的氧全部吸收,還原為N2排入大氣中。整個過程中,水流的氧化還原電流自正極轉向負極不斷地下降,可以通過氧化還原電位確定硝酸鹽去除的程度。基於硝酸鹽去除器中的水是在沒有溶氧的情況下被還原成為氮,還原反應是主導的,因此氧化還原的電流很低,通常在-50mv-250mv。氧化還原的電流高於- 50mv的時候,硝酸鹽去除的反應停留在硝酸鹽階段,如果氧化還原的電流低於-300mv的時候,硝酸鹽則已經全部被還原,於是這些水質處理細菌就會汲取硝酸鹽的氧產生HS。所以當氧化還原電位指示其電流不到-50mv或呈正極的時候,就要控制水族箱中的水繼續流入硝酸鹽去除器中。當氧化還原電位指示其電流低於-300mv的時候,就需要增加水族箱的水進入硝酸鹽去除器。只有密切注意硝酸鹽去除器的氧化還原電位的變化才能夠保證硝酸鹽去除的正常進行。

硝酸鹽