原子質量數
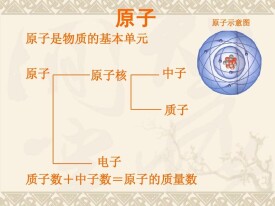
原子質量數
相對原子質量=一個原子的真實質量與C-12原子的真實質量的12分之1的比值。 ⑵由於電子的相對質子、中子的質量太小,可以忽略不計,所以:原子的質量≈所含質子的質量+所含中子的質量=Z×m+N×n )/C-12原子的真實質量=12×Z×m/C-12原子的真實質量+12×N×n
目錄
質子及中子-內部結構模型圖
相對原子質量=一個原子的真實質量與C-12原子的真實質量的12分之1的比值。
質量數=質子數+中子數
從宏觀角度,可以這樣去理解兩者的區別。
設一個質子的質量為m,一個中子的質量為n
⑴原子的質量=所含質子的質量+所含中子的質量+所含電子的質量
註:這是利用宏觀的質量守恆定律,其實在微觀世界遵守的是質能守恆。
⑵由於電子的相對質子、中子的質量太小,可以忽略不計,所以:
原子的質量≈所含質子的質量+所含中子的質量=Z×m+N×n
⑶相對原子質量≈12(Z×m+N×n)/C-12原子的真實質量
=12×Z×m/C-12原子的真實質量+12×N×n/C-12原子的真實質量
=Z×(12×m/C-12原子的真實質量)+N×(12×m/C-12原子的真實質量)
=Z×質子的相對質量+N×中子的相對質量
⑷由於質子的相對質量、中子的相對質量都近似等於1,因此
Z×質子的相對質量+N×中子的相對質量≈Z+N
而我們把Z+N稱為質量數
註:不能把質量數看作相對原子質量的近似,因為近似是將“Z×質子的相對質量+N×中子的相對質量”取整數,而質量數是先將質子的相對質量、中子的相對質量取整數后再相加。當然,絕大多數情況下,相對原子質量的近似和質量數,兩者數值相等,除非Z、N很大時有可能不相等。