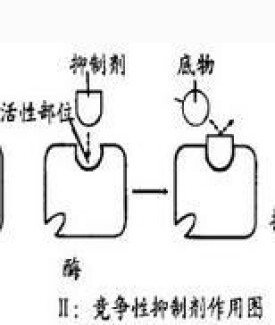
競爭性抑製劑
產生競爭性抑制作用的抑製劑
競爭性抑製劑是產生競爭性抑制作用的抑製劑。它與被抑制的酶的底物通常有結構上的相似性,能與底物競相爭奪酶分子上的結合位點,從而產生酶活性的可逆的抑制作用。而另一類競爭性抑製劑在化學結構和分子形狀上與底物無相似之處,因此並不在活性中心與酶結合,而是在活性中心以外的地方結合。然而一旦結合,酶的構象就發生變化,從而導致活性中心不能再結合底物。同樣,若底物先與活性中心結合,就會導致抑製劑結合部位的構象改變,致使抑製劑無法再與酶結合。因此,這一類競爭性抑製劑與底物在和酶結合這一點上也是相互排斥的。
第二種競爭性抑製劑與非競爭性抑製劑的差別在於,非競爭性抑製劑和底物可同時與酶結合形成三元複合物EIS,而前者不能。
如果抑製劑濃度恆定,則在低底物濃度([s])時抑制作用最為明顯,增大[s],抑制作用隨之降低,直到[s]增大至很濃時,抑制作用近於消失,達到未加抑製劑時的最大反應速度()水平,其動力學特徵是:表觀反應常數( )增大、不變。抑製程度只與抑製劑濃度有關。
①底物類似物例如,α-葡糖苷酶抑製劑如阿卡波糖(acarbose)、伏格列波糖(voglibose)和米格列醇(Miglitol)
②過渡態類似物如苯甲醯丙氨醛是胰凝乳蛋白酶的過渡態抑製劑。
③其它化合物有些化合物的平面結構與底物並不相似,但立體構象十分相近,也成為競爭性抑製劑。某些競爭性抑製劑的作用原理是抑製劑與一些酶活性中心的金屬離子絡合,妨礙了底物的進入,從而起到抑制酶活性的目的。
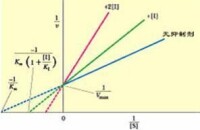
以此方程所作曲線和各參數的值如下圖所示:
更詳細的分析,可以由此參考雙倒數方程與米氏常數相關的資料。
競爭性抑製劑
①從雙倒數圖計算出表觀米氏常數,然後代入可計算出。
②從雙倒數圖求得各I濃度下的 值對相應[I]再作圖,從再製圖的縱截距可直接測得,從其橫截距可直接測得Ki。
③從不同固定[I]下所作一簇直線的斜率對相應[I]再製圖,其縱截距為,斜率為,橫截距即為-。
競爭性抑製劑
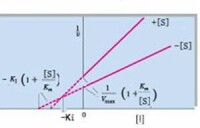
④Dixon作圖法求值
首先由此查看有關IC50的定義。它的值取決於實驗所用的酶和底物濃度,當酶的濃度固定時,IC50值與、 和 競爭性抑製劑
競爭性抑製劑
根據該方程式,當底物濃度大於值時,IC50值高於值,尤其當底物濃度較高時,值偏低更加明顯。