氣體實驗定律
建立理想氣體概念的實驗依據
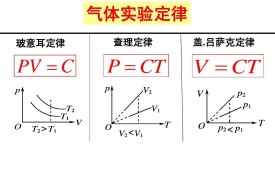
氣體實驗定律(experimental laws of gas),即關於氣體熱學行為的5個基本實驗定律,也是建立理想氣體概念的實驗依據。這5個定理分別是:①玻意耳定律、②查理定律、③蓋—呂薩克定律、④阿伏加德羅定律、⑤道爾頓分壓定律。
⑴容:質量某,溫況,壓強積反。
⑵式:==
⑶件:質量—圖溫線雙曲線
一定質量的氣體,當體積保持不變時,它的壓力p隨溫度t線性地變化,即p=p0(1+apt)式中p0,p分別是0℃和t℃時氣體的壓強,ap 是體積不變的氣體的壓力溫度係數。實驗測定,各種氣體的ap≈1/273°。
實驗表明,對空氣來說,在室溫和大氣壓下,以上三條定律近似正確,溫度越高,壓力越低,準確度越高;反之,溫度越低,壓力越高,偏離越大。(以空氣為例,在0℃,若壓強為1大氣壓時體積為1升,即pV等於1大氣壓·升,則當壓力增為500和1000大氣壓時,pV乘積增為1.34和1.99大氣壓·升,有明顯差別。)另外,同種氣體的av、ap都隨溫度變化,且稍有差別;不同氣體的av、ap也略有不同。溫度越高,壓力越低,這些差別就小,常溫下在壓力趨於零的極限情形,對於一切氣體,av=ap=1/273.15°。
一定質量的氣體,當壓強保持不變時,它的體積V隨溫度t線性地變化,即
V=V0(1+avt)式中V0,V分別是0℃和t℃時氣體的體積;av是壓力不變時氣體的體膨脹係數。實驗測定,各種氣體的av≈1/273°。
在相同的溫度和壓力下,1摩爾任何氣體都佔有同樣的體積。在T0=273.15K和p0=1大氣壓的標準狀態下,1摩爾任何氣體所佔體積為V0=22.41410×10-3米3/摩爾(m3·mol-1)。它也可表述為:在相同的溫度和壓力下,相同體積的任何氣體的分子數(或摩爾數)相等。在標準狀態下,單位體積氣體的分子數即J.洛喜密脫常量為n0=2.686773×1025m-3,因此,1摩爾氣體所含分子數為
NA=6.0221367×10^23 mol-1稱為阿伏伽德羅常量。根據摩爾的定義,組成物質系統的基本單元可以是原子,分子,也可以是離子,電子,其他粒子或這些粒子的特定組合。因此,阿伏伽德羅定律也可推廣為,1摩爾任何物質所包含的基本單元數都等於阿伏伽德羅常量。
以上討論限於化學純氣體。
混合氣體的壓力等於各成分的分壓力之和。某一成分的分壓力是指該成分單獨存在時(即在與混合氣體的溫度、體積相同,且與混合氣體中所含該成分的摩爾數相等的條件下,以化學純狀態存在時)的壓力。
以上5個氣體實驗定律分別是1662年R·玻意耳、1785年J·A·C·查理、1802年蓋—呂薩克、1811年A·阿伏加德羅、1802年J·道爾頓提出的。