能壘
能壘
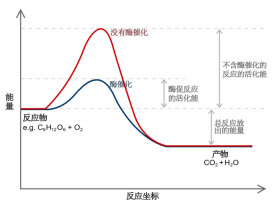
在受動力學限制的化學反應中,活化能 Ea 為活化碰撞的平均摩爾能量與所有碰撞的平均摩爾能量之差;而能壘E為活化絡合物與反應物的零點能之差。
能壘大則不易形成活化的中間產物,反應難以進行。能壘E為活化絡合物與反應物的零點能之差,是不同於活化能的。一般的化學反應都是在等溫等壓下進行,自發跟非自發是看delta G也就是吉布斯自由能變。無論哪種,要突破能壘,也就是活化能,都是因為要經歷一個過渡態(transient, or say, transition state)。自發跟非自發說的是熱力學(thermodynamics),活化能高低說的是動力學 (kinetics)。
活化分子含有的能參加化學反應的最低限度的能量,稱為化學反應的能壘,或稱能閾或能障。

能壘
依次採用分子力學、分子動力學、量子力學方法計算得到烴分子的最低能量構象,獲得了分子的三維尺寸,並與 動力學直徑進行了對比分析,並初步研究了烴分子尺寸與在MFI、FAU分子篩中擴散能壘的關係。結果表明,在分子篩催化研究中用三維尺寸描述烴分子大小比用動力學直徑更合理。與環烷烴、芳烴分子相比,長鏈烷烴分子結構柔性較大,長鏈烷烴分子尺寸不能只考慮其最低能量構象的尺寸,還應考慮分子構象的動力學變化。在同一分子篩中,隨烴分子最小截面尺寸的增加,擴散能壘增大;同一分子在MFI分子篩中的擴散能壘大於在FAU分子篩中的擴散能壘。研究結果對於探索分子篩擇形催化機理具有一定的理論價值。
Insight II軟體中的Solids-Diffusion模塊提供了研究分子在晶格中或表面上擴散行為的工具。該方法提出,分子在分子篩孔道中沿某一路徑擴散時,受該路徑上存在的熱力學能壘的控制。這種熱力學能壘稱為擴散能壘,它代表分子通過孔道時所需要克服的能量。分子在分子篩孔道內的擴散速率主要由擴散能壘決定,因此,擴散能壘可以從能量的角度給出分子在分子篩孔道中擴散的難易,進而獲得分子擴散的相對快慢。
計算分子在分子篩孔道中的擴散能壘的主要步驟:在分子篩主體結構中預先用數個贗原子定義好擴散路徑,客體分子沿該路徑按定義好的步長(計算設定為0.05nm)移動;在每一個連續的位置上,對由分子篩和擴散分子組成的體系 進行能量優化,並記錄優化得到的最低能量,由此可以得到一條沿軌跡坐標變化的擴散能量曲線。擴散能量曲線的峰值(Emax )和谷值(Emin )之差即為擴散能壘(ED )。擴散能壘計算中採用CVFF力場(Consistent valenceforce field)。計算中分子篩的骨架原子均固定在晶體學坐標位置。
不同異構程度的烷烴在M FI分子篩孔道中的擴散能壘有明顯差別;隨著異構程度的增加,烷烴分子最小截面尺寸增加,擴散能壘有明顯增加。這是由於MFI分子篩孔道尺寸較小,隨著分子最小截面尺寸的增加,分子與孔道壁原子的相互作用增強,擴散變得困難。但它們在FAU分子篩孔道中的 擴散能 壘並沒有明顯變化,這是由於FAU分子篩有效孔徑為0.73nm,比這幾種烷烴分子的最小截面尺寸大得多,分子篩孔道對分子擴散限制作用均不明顯,分子擴散均較自由。環烷烴、芳烴分子在MFI分子篩孔道中的擴散能壘隨分子最小截面尺寸的增加有明顯增加,在FAU分子篩中擴散能壘的變化規律與MFI分子篩中的相同。同一分子在MFI分子篩中的擴散能壘均比在FAU分子篩中的大,這是由於MFI分子篩的有效孔徑比FAU分子篩小,分子在MFI分子篩中受到的擴散限制作用更大,擴散更困難。
選取了乙烷和氫過氧自由基的氫提取反應為參考反應,其它反應作為目標反應,用等鍵反應方法對目標反應在HF/6-31+G(d)水平的近似能壘和反應速率常數進行了校正。為了驗證方法的可靠性,選取C以下的烷烴分子體系,對等鍵反應方法校正結果和高精度CCSD(T)/CBS 直接計算結果進行了比較,最大絕對誤差為5.58kJ∙mol-1,因此,採用等鍵反應方法只需用低水平HF從頭算方法就可以再現高精度CCSD(T)/CBS 計算結果,從而解決了該反應類中大分子體系的能壘的精確計算。作為碳氫化合物中低溫燃燒模擬中重要的烷烴與氫過氧自由基氫提取反應提供了準確的動力學參數。
根據傳統過渡態理論,雙分子反應如下:X+Y→products
此反應的速率常數的表達式為:k=κ(kT/h)(Q /QQ)exp(-ΔV /RT)其中,κ 為隧穿因子,k是玻爾茲曼常數,h是普朗克常數,T為溫度,R是理想氣體常數,Q 是過渡態的配分函數,Q、Q 分別是反應物X和反應物 Y的配分函數,ΔV 是反應的能壘。以上配分函數只包含振動、轉動和平動的貢獻,僅與優化得到的振動頻率和幾何結構有關,而與單點能無關,因此單點能的計算級別隻影響反應的能壘。
設P為參考反應,T為目標反應,根據等鍵反應的方法18 目標反應勢能如下:
ΔV = ΔV + ΔΔV
ΔΔV = ΔV - ΔV
其中,≠為表示過渡態的符號,ΔV 和 ΔV 分別為高級別從頭算理論方法和低級別從頭算理論方法計算得到的參考反應的反應能壘,ΔΔV 為參考反應能壘校正值。ΔV 為低級別從頭算理論方法計算得到的目標反應的反應能壘,ΔV 為通過反應能壘校正得到的高精度目標反應的反應能壘。目標反應的精確速率常數kʹ可通過目標反應的速率常數k與參考反應的能壘校正項得到:
kʹ = k exp[(-ΔΔV )/RT]
用等鍵反應方法對目標反應在HF/6-31+G(d)水平的近似能壘進行了校正。為了驗證方法的可靠性,選取C5 以下的分子體系,用高精度CCSD(T)/CBS 方法進行了精確計算,外推數據E 和E (見 Supporting Information),其結果與直接採用HF方法計算及用等鍵反應方法校正得到的反應能壘比較可以看出,HF方法和CCSD(T)/CBS方法計算反應能壘的平均絕對誤差高達90.19kJ∙mol ,遠大於等鍵反應方法和CCSD(T)/CBS方法計算反應能壘的平均絕對誤差2.96kJ∙mol 。HF方法和CCSD(T)/CBS方法計算反應能壘的最大絕對誤差為92.81 kJ∙mol ,仍然遠大於等鍵反應方法和CCSD(T)/CBS方法計算反應能壘的最大絕對誤差5.58kJ∙mol 。用等鍵反應方法校正過後的結果已在化學反應精度內,表明烷烴與氫過氧自由基氫提取反應用HF方法計算經等鍵反應方法校正即可得到可靠的反應能壘。對23個目標反應均採用等鍵反應方法對其能壘進行了校正。