離子平衡
離子平衡
英文名稱: ionic equilibrium
離子平衡
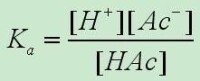
離子平衡
對任何指定的弱酸弱鹼而言,或是對任一指定的酸鹼平衡而言,在指定溫度下,其Ka、Kb都是定值,並不隨任何平衡組分的濃度(不論是起始濃度還是平衡濃度)而改變。
電離常數的大小反映了改電解質電離程度的大小。電離程度的大小也可以用電離度α表示。
Ki與α之間的關係,以Ka為例:
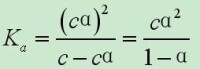
離子平衡
Ka:電離常數
α:電離度(已電離電解質的量 / 電解質總量 X 100%
或 已電離電解質濃度mol/L / 電解質總濃度mol/L X 100%)
水的離子積常數k w=1*10-14