電離
電解的前提和條件
電離有化學電離和物理電離之分。化學上的電離是指電解質在水溶液或熔融狀態下離解成帶相反電荷並自由移動離子的一種過程。在水溶液電離有完全電離和不完全電離之分,強電解質在水溶液中完全電離,弱電解質在水溶液中呈現不完全電離。電離不同於電解,電離過程不需要通電,而電解是通電后,電解質溶液中陰陽離子向兩極移動併發生氧化還原反應的過程,從這個意義上講,電離是電解的前提和條件。物理電離是指不帶電的粒子在高壓電弧或者高能射線等的作用下,變成了帶電的粒子的過程。
電解質在水溶液中或熔融狀態下離解成自由移動陰陽離子的過程。
將電子從基態激發到脫離原子,叫做電離,這時所需的能量叫電離電勢能。
例如氫原子中基態的能量為-13.6eV(電子伏特),使電子電離的電離勢能就是13.6eV(即2.18×10-18焦耳)。
簡單點說,就是電解質在水溶液中或熔融狀態下產生自由移動的離子的過程。
原子是由原子核及其周圍的帶負電的電子所組成。原子核由帶正電的質子和不帶電的中子構成,由於質子所帶的 正電荷數與電子的負電荷數相等所以原子是中性的。原子最外層的電子稱為價電子。所謂電離,就是原子受到外界的作用如被加速的電子或離子與原子碰撞時使原子中的外層電子特別是價電子擺脫原子核的束縛而脫離,原子成為帶一個或幾個正電荷的離子這就是陽離子。如果在碰撞中原子得到了電子,則就成為陰離子。
正電荷數與電子的負電荷數相等所以原子是中性的。原子最外層的電子稱為價電子。所謂電離,就是原子受到外界的作用如被加速的電子或離子與原子碰撞時使原子中的外層電子特別是價電子擺脫原子核的束縛而脫離,原子成為帶一個或幾個正電荷的離子這就是陽離子。如果在碰撞中原子得到了電子,則就成為陰離子。

原子
電離時生成的陽離子全部是氫離子(H﹢)的化合物叫做酸,在水溶液中電離而生出的陰離子全部是氫氧根離子(OH﹣)的化合物叫做。如果我們的思維突破以水為介質,問題類似的轉移,比如在液氨為溶劑的情況下,如果溶質電離產生陽離子的物質就是酸,電離產生陰離子的物質就是鹼了,下面就總結一下經常遇到也是很少遇到一些溶劑本身自偶電離產生的陰陽離子,便於我們做一些判斷,或者提高我們的思維的深度和廣度:
H2O→H++OH-
2NH3→NH4++NH2-
非質子(H+)的自偶電離:
2SO2→SO2++SO32-
N2O4→NO++NO3-
電離有兩種,一種是化學上的電離,另一種是物理上的電離。
上面講的是化學中的電離。化學上的電離是指電解質在一定條件下(例如溶於某些溶劑、加熱熔化等),電離成可自由移動的離子的過程。在電離前可能是不含有離子(例如氯化氫),也可能是儘管有離子,但是裡面的離子不能自由移動(例如氯化鈉固體)。
固體溶質進入溶液后,首先發生微粒(分子或離子)的擴散(吸熱)過程,接著是形成水合離子或水合分子的水合過程(放熱)。這裡有化學鍵的破壞和形成,嚴格說都是物理-化學過程。對於強電解質來說,溶解和電離是難以截然分開的,因為離子的擴散就是電離。不過對於弱電解質說來,首先是擴散成分子(吸熱),然後在水分子作用下,化學鍵被破壞而電離成為水合的自由離子(這裡總體表現是吸熱還是放熱要看破壞化學鍵需要的能量多,還是水合釋放能量多了)。
物理上的電離是指不帶電的粒子在高壓電弧或者高能射線等的作用下,變成了帶電的粒子的過程。例如地球的大氣層中的電離層里的粒子就屬於這種情況。電離層中的粒子在宇宙中的高能射線的作用下,電離成了帶電的粒子。
電離通常包含物理過程和化學過程,物理過程就是溶解,化學過程不是化學變化,化學變化除了舊鍵的斷裂還要有新鍵的生成,所以電離不是化學變化。而化學過程指的是在溶劑分子(如水分子)作用下,電解質中原有的一部分化學鍵斷裂。有的電離過程斷裂的化學鍵是離子鍵,如氯化鈉等大多數鹽類的電離,氫氧化鈉等大多數鹼的電離。也有的電離過程斷裂的是共價鍵,如硫酸的電離,氯化氫的電離等等。
電離有完全電離和不完全電離之分。強電解質在水溶液中是完全電離的,如硫酸、氯化鈉、氫氧化鈉等。弱電解質在水溶液中呈現不完全電離狀態,如氯化汞的電離,硫化氫的電離等。
應當注意,電離與電解是有區別的。電離過程根本不需要通電(會電離的物質,只要溶解在特定溶劑里就會電離),而電解則需要外部通以電流。
物理電離的方式:高溫電場高能輻射
電離相關電離中的吸放熱固體溶質進入溶液后,首先發生微粒(分子或離子)的擴散(吸熱)過程,接著是形成水合離子或水合分子的水合過程(放熱)。這裡有化學鍵的破壞和形成,嚴格說都是物理-化學過程。對於強電解質來說,溶解和電離是難以截然分開的,因為離子的擴散就是電離。不過對於弱電解質說來,首先是擴散成分子(吸熱),然後在水分子作用下,化學鍵被破壞而電離成為水合的自由離子(這裡總體表現是吸熱還是放熱要看破壞化學鍵需要的能量多,還是水合釋放能量多了,因此,電離過程不一定是吸熱)。完全電離和不完全電離電離有完全電離和不完全電離之分。強電解質在水溶液中是完全電離的,如硫酸、氯化鈉、氫氧化鈉等。弱電解質在水溶液中呈現不完全電離狀態,如氯化汞的電離,硫化氫的電離等。電離和電解的區別應當注意,電離與電解是有區別的。電離過程根本不需要通電(會電離的物質,只要溶解在特定溶劑里就會電離),而電解則需要外部通以電流。
水的電解實驗以及電解和導電度的問題研究始於1880年。1884年,法拉第在其《關於電的實驗研究》一文中第一次使用“電解質”、“離子”等術語。當時普遍認為,只有外加電解電壓時電解質才會分解為正負離子。到1884-1887年間,瑞典化學家阿倫尼烏斯連續發表有關論說。在《關於溶質在水中的離解》一文中闡述了電離學說的基本觀點:(1)由於溶劑的作用,電解質在水中自動解離為帶相反電荷的正負離子。(2)在水溶液中每一種電解質都是由(在電解意義上和化學意義上)離解了的分子和未離解的分子兩部分組成,後者在稀釋時繼續離解,以致在無限稀釋的溶液中只有離解了的分子存在。這篇論文的發表標誌著電離理論的正式確立。阿倫尼烏斯電離理論,成為溝通物理學和化學的重要橋樑,促成了物理化學這門學科的確定和發展,也使整個化學的發展翻開了新的一頁。
電解質
凡是在水溶液或熔融狀態下能夠解離成陽離子與陰離子而導電的化合物叫電解質。例如酸、鹼、鹽、活潑金屬氧化物、過氧化物、氫化物等。在水溶液或熔融狀態下都不能導電的化合物叫非電解質。電解質和非電解質的區別就在於溶於水或熔融狀態下能否導電。
離子化合物和某些具有極性的共價化合物在水溶液里全部電離為離子,沒有分子存在,這樣的電解質屬於強電解質。強酸、強鹼、大部分鹽類都是強電解質。弱酸、弱鹼、水等化合物在水溶液中部分電離成離子,存在電解質分子和離子之間的電離平衡,是弱電解質。電解質在溶劑中能否完全電離是區分強電解質和弱電解質的依據。
電離平衡
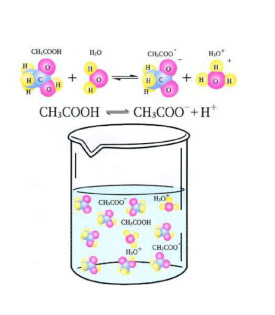
一定溫度下,弱電解質溶液中當弱電解質分子電離成離子的速率與離子重新結合成分子的速率相等時,弱電解質分子和離子濃度不再改變的狀態稱為弱電解質的電離平衡。
在一定溫度下,一定濃度的弱電解質溶液中,弱電解質達到電離平衡時,已電離的電解質分子數占原來總分子數的百分數,稱作該電解質的電離度,用α表示。一般來說,在相同條件下,電解質越強,電離度越大,因此弱電解質的相對強弱,可用電離度的大小定量表示。
在一定溫度下,當弱電解質電離達到平衡時,電離的離子濃度的乘積與未電離的分子濃度的比值叫做該弱電解質的電離平衡常數,又稱電離常數或離解常數,用Ki表示。
電離有化學上的電離和物理上的電離之分。
化學電離
化學電離是指電解質在一定條件下(例如溶於某些溶劑、加熱熔化等),電離成可自由移動的離子的過程。在電離前可能是不含有離子(例如氯化氫),也可能是儘管有離子,但是裡面的離子不能自由移動(例如氯化鈉固體)。
化學電離又可分為完全電離和不完全電離(部分電離)。例如酸在水溶液中電離,生成水合氫離子和酸根離子。強酸完全電離,弱酸部分電離。在弱酸溶液中,始終存在未電離的弱酸分子與電離出的氫離子和酸根離子之間的平衡。
物理電離
物理電離是指不帶電的粒子在高壓電弧或者高能射線等的作用下,變成了帶電的粒子的過程。例如地球的大氣層中的電離層里的粒子就屬於這種情況。電離層中的粒子在宇宙中的高能射線的作用下,電離成了帶電的粒子。物理電離的方式有高溫、電場與高能輻射。
在正常狀態下,原子處於最低能級,這時電子在離核最近的軌道上運動,這種狀態叫基態。某元素的處於基態的一個氣態原子失去一個電子形成一個+1價的氣態陽離子時所需要的能量,叫作這種元素的第一電離能,用I1表示。使某元素的一個+1價的氣態陽離子失去一個電子形成一個+2價的氣態陽離子時所需的能量,叫作這種元素的第二電離能,用I2表示。依此類推,還有元素的第三電離能、第四電離能等,通常所說的電離能一般指第一電離能。電離能的大小可以用來衡量元素的原子失電子的難易程度,電離能越小,失電子越容易,金屬性越強。一般地,同一元素隨著原子失去電子數的增加,失電子越來越難,因此同一元素的各級電離能依次升高。
電離輻射,是指能直接或間接引起物質原子電離的輻射,是原子以電磁波或粒子形式傳遞時所釋放的一種能量。早在1895年11月德國物理學家倫琴發現了一種看不見但能穿透物質的射線,稱為X射線,X射線被發現后不久即在醫學中得到應用。1896年3月,法國科學家貝克勒爾發現鈾元素能發射出一種不可見的具有穿透力的輻射,能使空氣電離和膠片感光。1898年7月,居里夫婦首次從瀝青鈾礦中提煉出一種新元素,命名為釙(Po),同年12月又成功分離出另一種新元素鐳(Ra),並提出了一個新名詞“放射性”。在核事業發展的早期,用於研究和應用的輻射源主要是來自自然界的放射性物質,如可支撐γ射線源的鐳、可製成中子源的鐳-鈹混合物等,並通常被封裝在小容器內,以達到使用安全和操作方便的目的。此後,隨著核反應堆的發展,出現了人工放射性核素,輻射源的種類及其應用日益繁多,使用量也不斷增加。目前,核技術已廣泛應用於國防、科研、工業、農業、醫學、通訊、交通、環保、資源開發和科學研究等各個領域,對促進人類文明建設發揮了不可替代的作用。