陰陽離子
由原子核核外電子易得電子與易失電子形成的
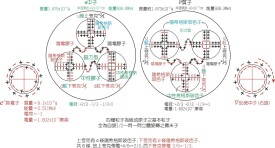
陰、陽離子就是由原子核核外電子易得電子與易失電子形成的。陽離子是指原子由於外界作用失去一個或幾個電子,使其最外層電子數達到8個或2個電子的穩定結構。
目錄
離子是指原子由於自身或外界的作用而失去或得到一個或幾個電子使其達到最外層電子數為8個(如第一層是最外層,則為2個)的穩定結構。這一過程稱為電離。電離過程所需或放出的能量稱為電離能。在化學反應中,金屬元素原子失去最外層電子,非金屬原子得到電子,從而使參加反應的原子或原子團帶上電荷。帶電荷的原子叫做離子,帶正電荷的原子叫做陽離子,帶負電荷的原子叫做陰離子。陰、陽離子由於靜電作用而形成不帶電性的化合物。與分子、原子一樣,離子也是構成物質的基本粒子。如氯化鈉就是由氯離子和鈉離子構成的。
陰、陽離子就是由原子核核外電子易得電子與易失電子形成的。易得電子顯負價,就是陰離子,易失電子顯正價,是陽離子。
陽離子是指原子由於外界作用失去一個或幾個電子,使其最外層電子數達到8個或2個電子的穩定結構。原子半徑越大的原子其失電子能力越強,金屬性也就越強。金屬性最強的金屬元素是鈁(Fr)。陰離子是指原子由於自身的吸引作用從外界吸引到一個或幾個電子使其最外層電子數達到8個或2個電子的穩定結構。半徑越小的原子其吸收電子的能力也就越強,就越容易形成陰離子,非金屬性就越強。非金屬性最強元素是氟。要是光不知道陰陽離子的意義,那有個最簡單的方法---看加減號,正為陽,負為陰。如果想知道元素對應的陰陽離子,那就需要靠元素周期表的知識了,一般說來,原子核最外層電子數小於4的通常形成陽離子(就是帶正號的),大於4的通常形成陰離子(也就是帶負號的),還有一個規律,原子核最外層電子數也就決定了該元素的化合價,就是正號或者負號前的數。
由陰陽離子構成的物質在固態時,不能導電;因為在固體中,陰陽離子之間存在強烈的靜電作用力,使得陰陽離子不能自由移動。